Hvilke slags kræfter forårsager forbindelser?
* ioniske bindinger: Disse dannes, når et atom donerer Et elektron til et andet atom, der skaber ioner med modsatte ladninger. Den elektrostatiske tiltrækning mellem disse ioner holder forbindelsen sammen. Eksempler inkluderer NaCl (tabel salt), hvor natrium (Na+) mister et elektron til klor (Cl-) og MgO (magnesiumoxid), hvor magnesium (Mg2+) mister to elektroner til ilt (O2-).
* kovalente obligationer: Disse dannes, når atomer deler Elektroner, der skaber en region med elektrondensitet mellem atomerne. Denne delte elektrondensitet skaber en attraktiv kraft, der holder atomerne sammen. Eksempler inkluderer H2O (vand), hvor brint (H) atomer deler elektroner med et ilt (O) atom og CO2 (kuldioxid), hvor carbon (C) deler elektroner med to ilt (O) atomer.
* Metalliske obligationer: Disse forekommer i metaller, hvor valenselektronerne delokaliseres og deles mellem alle metalatomer. Dette skaber et "hav" af elektroner, der holder metalatomerne sammen.
Andre kræfter, der kan bidrage til sammensat dannelse, skønt de er svagere end elektrostatiske kræfter, inkluderer:
* Hydrogenbinding: Dette er en speciel type dipol-dipolinteraktion, der opstår, når brint er bundet til et stærkt elektronegativt atom (som ilt eller nitrogen). Det er en stærkere form for intermolekylær kraft end dipol-dipol-interaktioner, men stadig svagere end ioniske eller kovalente bindinger.
* van der Waals Forces: Dette er svage, midlertidige attraktioner, der forekommer mellem molekyler på grund af udsving i elektronfordeling. De er vigtige for at holde ikke -polære molekyler sammen, men er meget svagere end ioniske eller kovalente bindinger.
Det er vigtigt at huske, at alle disse kræfter arbejder sammen for at skabe og vedligeholde forbindelser. Styrken af disse kræfter bestemmer forbindelsens egenskaber, såsom dens smeltepunkt, kogepunkt og opløselighed.
 Varme artikler
Varme artikler
-
 Mange små forskelle bidrager til en stor variationEt stof kan påvirke mennesker meget forskelligt. Kredit:Colourbox Der er ikke en enkelt hovedårsag til, at visse stoffer påvirker mennesker forskelligt, men derimod mange små faktorer. ETH-forsker
Mange små forskelle bidrager til en stor variationEt stof kan påvirke mennesker meget forskelligt. Kredit:Colourbox Der er ikke en enkelt hovedårsag til, at visse stoffer påvirker mennesker forskelligt, men derimod mange små faktorer. ETH-forsker -
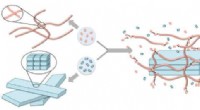 Molekylært stillads hjælper konstruktion på nanoskalaKredit:Okinawa Institute of Science and Technology Graduate University Hvis du vil bygge et højt hus, du skal bruge stillads. Professor Ye Zhang og kolleger ved Okinawa Institute of Science and Te
Molekylært stillads hjælper konstruktion på nanoskalaKredit:Okinawa Institute of Science and Technology Graduate University Hvis du vil bygge et højt hus, du skal bruge stillads. Professor Ye Zhang og kolleger ved Okinawa Institute of Science and Te -
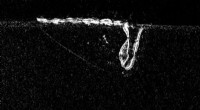 Sprængning af dine (små) bobler:ny forskning peger på vejen mod porefri 3D-printDette røntgenbillede taget ved APS viser en lasersmeltende aluminium under den additive fremstillingsproces. Til venstre for laseren kan du se små porer skabt under processen, som over tid kan skabe f
Sprængning af dine (små) bobler:ny forskning peger på vejen mod porefri 3D-printDette røntgenbillede taget ved APS viser en lasersmeltende aluminium under den additive fremstillingsproces. Til venstre for laseren kan du se små porer skabt under processen, som over tid kan skabe f -
 Farligt vildtgræs vil blive brugt i batterierSupercapacitor Kredit:NUST MISIS Hogweed, som vokser over store områder i Rusland, kan være nyttigt som materiale til batterier. Forskere fra NUST MISIS har undersøgt mulighederne for fibrøse stof
Farligt vildtgræs vil blive brugt i batterierSupercapacitor Kredit:NUST MISIS Hogweed, som vokser over store områder i Rusland, kan være nyttigt som materiale til batterier. Forskere fra NUST MISIS har undersøgt mulighederne for fibrøse stof


