Hvad bestemmer, om en forbindelse vil opløses i vand?
1. Polaritet:
* "som opløser som" :Dette er det grundlæggende princip. Vand er et meget polært molekyle, hvilket betyder, at det har en positiv og en negativ ende på grund af ujævn elektronfordeling. Stoffer, der også er polære (som salte, sukker og mange alkoholer), opløses godt i vand, fordi deres molekyler kan interagere med vandmolekyler gennem elektrostatiske attraktioner (hydrogenbindinger og dipol-dipol-interaktioner).
* ikke-polære forbindelser :Forbindelser med ringe eller ingen polaritet (som olier og fedt) opløses ikke i vand. Deres molekyler kan ikke danne stærke attraktive kræfter med vandmolekyler.
2. Intermolekylære kræfter:
* Hydrogenbinding: Stærkeste intermolekylær kraft, der dannes mellem hydrogenatomer bundet til stærkt elektronegative atomer (som ilt eller nitrogen). Forbindelser, der er i stand til hydrogenbinding med vand, er mere tilbøjelige til at opløses.
* dipol-dipolinteraktioner: Forekommer mellem polære molekyler, svagere end brintbindinger, men bidrager stadig til opløselighed.
* London Dispersion Forces: Svageste kræfter, der er til stede i alle molekyler, men stærkere i større molekyler. Ikke-polære forbindelser er udelukkende afhængige af disse kræfter, som er utilstrækkelige til at opløse i vand.
3. Molekylær størrelse og form:
* mindre molekyler :Opløs generelt bedre, fordi de lettere kan interagere med vandmolekyler.
* form :Hvis et molekyle har en form, der giver mulighed for gunstige interaktioner med vand, er det mere sandsynligt, at det opløses.
4. Temperatur:
* øget temperatur :Øger generelt opløseligheden af faste stoffer og gasser i vand. Dette skyldes, at højere temperatur giver mere energi for molekyler til at overvinde intermolekylære kræfter og bryde fra hinanden.
5. Tryk:
* øget tryk :Øger generelt opløseligheden af gasser i vand. Dette skyldes, at højere tryk tvinger flere gasmolekyler til opløsning.
Kortfattet:
En forbindelse er mere tilbøjelig til at opløses i vand, hvis den er polær, kan danne brintbindinger, er lille og har en gunstig form, og temperaturen er relativt høj.
Undtagelser og andre faktorer:
* ioniske forbindelser :Disse opløses i vand ved at adskille sig i deres ioner, som derefter er omgivet af vandmolekyler.
* Nogle ikke-polære stoffer :Kan have begrænset opløselighed i vand på grund af svage interaktioner eller interaktioner med specifikke dele af molekylet.
* tilstedeværelse af andre opløste stoffer :Kan påvirke opløseligheden af en given forbindelse.
Det er vigtigt at huske, at opløselighed er et komplekst fænomen. Selvom dette er de vigtigste faktorer, der påvirker det, er der mange specifikke tilfælde og undtagelser.
Sidste artikelHvad er et andet navn på hydrolyse?
Næste artikelHvilke 2 stoffer udgør rygraden eller siderne af DNA -molekyle?
 Varme artikler
Varme artikler
-
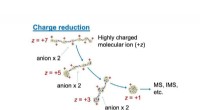 Et kæmpe fremskridt inden for spektrometriEn afbildning af ladningsreduktionsproces, der bruges som en forbehandlingsproces af massespektrometri, MS (eller ionmobilitetsspektrometri, IMS). For at øge nøjagtigheden af spektrum, overskydende
Et kæmpe fremskridt inden for spektrometriEn afbildning af ladningsreduktionsproces, der bruges som en forbehandlingsproces af massespektrometri, MS (eller ionmobilitetsspektrometri, IMS). For at øge nøjagtigheden af spektrum, overskydende -
 Biologis behov for hastighed tolererer nogle få fejlAnatoly Kolomeisky, venstre, og Oleg Igoshin. Kredit:Jeff Fitlow/Rice University Biologien skal have travlt. Ved at afbalancere hastighed og nøjagtighed for at duplikere DNA, producere proteiner o
Biologis behov for hastighed tolererer nogle få fejlAnatoly Kolomeisky, venstre, og Oleg Igoshin. Kredit:Jeff Fitlow/Rice University Biologien skal have travlt. Ved at afbalancere hastighed og nøjagtighed for at duplikere DNA, producere proteiner o -
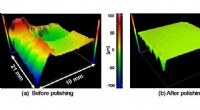 Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el
Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el -
 Forskere laver næste generation, batterikomponent med høj sejhedForskning viser, at grafen (rGO) kan hjælpe med at forhindre spredning af revner i keramiske materialer, der bruges til batterielektrolytter. Kredit:Brown University Et hold af Brown University-fo
Forskere laver næste generation, batterikomponent med høj sejhedForskning viser, at grafen (rGO) kan hjælpe med at forhindre spredning af revner i keramiske materialer, der bruges til batterielektrolytter. Kredit:Brown University Et hold af Brown University-fo
- Hvordan en organisme opretholder sine interne kropsforhold såsom temperatur og mængde vandnærings…
- Radioaktivt kulstof fra atombombe -test fundet i dybe havgrave
- Hvem er lang afstand fra Jordens sol eller måne stjerner?
- Nye materialer af perovskit udfordrer traditionelle forestillinger om højtrykskemi
- Hvad er de vigtigste dele af en dyrecelle?
- Rekordstor Texas tørke mere alvorlig end tidligere antaget


