Hvilken type forbindelser kan opløses i vand?
Her er en sammenbrud:
forbindelser, der opløses godt i vand:
* ioniske forbindelser: Disse forbindelser består af ladede ioner, der holdes sammen af elektrostatiske kræfter. Vandets polaritet giver det mulighed for at omringe ionerne og adskille dem, opløste forbindelsen. Eksempler inkluderer bordsalt (NaCl), kaliumchlorid (KCL) og natriumhydroxid (NaOH).
* polære kovalente forbindelser: Disse forbindelser har ujævn deling af elektroner, hvilket skaber delvis positive og negative ladninger. Vand kan danne hydrogenbindinger med disse delvise ladninger, hvilket hjælper med at opløse dem. Eksempler inkluderer sukker (saccharose), ethanol og eddikesyre.
Forbindelser, der ikke opløses godt i vand:
* ikke -polære kovalente forbindelser: Disse forbindelser har endda deling af elektroner, hvilket resulterer i ingen delvise ladninger. Vand kan ikke interagere med disse molekyler effektivt, så de opløses ikke godt. Eksempler inkluderer olier, fedt og benzin.
Vigtig note:
* Opløseligheden af en forbindelse påvirkes af flere faktorer, herunder temperatur, tryk og tilstedeværelsen af andre stoffer.
* Nogle forbindelser betragtes som delvist opløselige i vand, hvilket betyder, at de opløses i begrænset omfang.
Fortæl mig, hvis du gerne vil have mig til at forklare nogen af disse koncepter mere detaljeret!
Sidste artikelHvilke egenskaber har vand som et resultat af at være polært molekyle?
Næste artikelHvordan parres DNA -molekyler korrekt?
 Varme artikler
Varme artikler
-
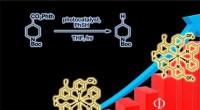 Inspireret af fotosyntese, forskere dobbeltreaktion kvanteeffektivitetReaktionens kvanteudbytte, sådan måler forskere effektiviteten af en lysaktiveret reaktion. Kredit:Anna Zieleniewska. Ud fra inspiration fra fotosyntese og den måde, hvorpå den kan opnå høj effe
Inspireret af fotosyntese, forskere dobbeltreaktion kvanteeffektivitetReaktionens kvanteudbytte, sådan måler forskere effektiviteten af en lysaktiveret reaktion. Kredit:Anna Zieleniewska. Ud fra inspiration fra fotosyntese og den måde, hvorpå den kan opnå høj effe -
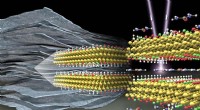 Hurtig og rasende:Ny klasse af 2D-materialer lagrer elektrisk energiMXener er 2D-materialer, der danner flerlagspartikler (venstre), som pseudokondensatorer er lavet af. Skinnende røntgenlys på MXener afslørede ændringer i deres kemiske struktur ved interkalation af u
Hurtig og rasende:Ny klasse af 2D-materialer lagrer elektrisk energiMXener er 2D-materialer, der danner flerlagspartikler (venstre), som pseudokondensatorer er lavet af. Skinnende røntgenlys på MXener afslørede ændringer i deres kemiske struktur ved interkalation af u -
 Undersøgelse bekræfter høj strålingsmodstand af højentropi-karbidkeramikKredit:Journal of the European Ceramic Society (2022). DOI:10.1016/j.jeurceramsoc.2022.01.061 En ny undersøgelse om bestrålingsevaluering af højentropi carbid keramik (HECCer) har påvist deres bemæ
Undersøgelse bekræfter høj strålingsmodstand af højentropi-karbidkeramikKredit:Journal of the European Ceramic Society (2022). DOI:10.1016/j.jeurceramsoc.2022.01.061 En ny undersøgelse om bestrålingsevaluering af højentropi carbid keramik (HECCer) har påvist deres bemæ -
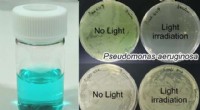 En trojansk hest tilgang kan føre til behandlinger for nogle antibiotika-resistente bakterierEn opløsning af det ekstracellulære hæmoptagelsessystem protein A (HasA) med galliumphthalocyanin (venstre) og resultaterne af sterilisering af Pseudomonas aeruginosa og Escherichia coli behandlet med
En trojansk hest tilgang kan føre til behandlinger for nogle antibiotika-resistente bakterierEn opløsning af det ekstracellulære hæmoptagelsessystem protein A (HasA) med galliumphthalocyanin (venstre) og resultaterne af sterilisering af Pseudomonas aeruginosa og Escherichia coli behandlet med
- Hvordan ændres den elektriske kraft mellem to positive ladninger, hvis afstand tredoblet?
- Superstrømme er blevet chirale:ny type superledende forbindelse
- Hvad er den kemiske formlula af kaliumsulfat og oxalsyre?
- Hvad er et eksempel på gensidig afhængighed i biologi?
- SoftBank Groups ni-måneders nettoresultat stiger mere end 50 %
- Hitomi -satellitten glimtede kort i universet,


