Hvilke egenskaber har vand som et resultat af at være polært molekyle?
1. Høje smelte- og kogepunkter:
* De stærke hydrogenbindinger mellem vandmolekyler kræver en betydelig mængde energi for at bryde, hvilket fører til relativt høj smeltning (0 ° C) og kogende (100 ° C) punkter sammenlignet med andre molekyler af lignende størrelse.
2. Fremragende opløsningsmiddel:
* Vandets polaritet giver det mulighed for let at opløse polære og ioniske stoffer som salte, sukker og mange andre organiske molekyler. Den delvist positive ende af et vandmolekyle tiltrækker negative ioner, mens den delvist negative ende tiltrækker positive ioner.
3. Høj overfladespænding:
* Vandmolekyler ved overfladen danner stærke brintbindinger med deres naboer, hvilket skaber en sammenhængende kraft, der giver vand en høj overfladespænding. Dette er grunden til, at insekter kan gå på vandet.
4. Kapillær handling:
* De sammenhængende kræfter mellem vandmolekyler og de klæbende kræfter mellem vandmolekyler og væggene i smalle rør, ligesom dem i planter, får vand til at stige mod tyngdekraften, et fænomen kendt som kapillær handling.
5. Høj specifik varmekapacitet:
* Vand har en høj specifik varmekapacitet, hvilket betyder, at det kræver en masse energi at hæve temperaturen. Dette skyldes de brintbindinger, der skal brydes for at øge den kinetiske energi af vandmolekyler. Denne egenskab hjælper moderate temperaturer i organismer og miljøet.
6. Unik tæthedsanomali:
* I modsætning til de fleste stoffer er vand mindre tæt som en fast (is) end som en væske. Dette skyldes den brintbinding, der skaber en mere åben, krystallinsk struktur i is. Denne afvigelse er afgørende for livet i akvatiske miljøer, fordi det giver vandmasser at fryse ovenfra og ned og isolere vandet nedenfor.
7. Reaktivitet:
* Vandets polaritet gør det til en god reaktant i mange kemiske reaktioner, herunder hydrolyse (nedbrydning af molekyler ved tilsætning af vand) og dehydreringssyntese (fjernelse af vand til dannelse af nye bindinger).
Sammenfattende er Water's polaritet drivkraften bag dens unikke egenskaber, hvilket gør det vigtigt for livet på jorden.
 Varme artikler
Varme artikler
-
 Ny biosensor zymonsyre viser ændringer i pH -værdiDr. Franz Schilling (til venstre), Stephan Düwel (i midten) og Christian Hundshammer (th) har udviklet en biosensor, der kan bruges til at vise ændringer i pH -værdien inde i kroppen ved hjælp af MR.
Ny biosensor zymonsyre viser ændringer i pH -værdiDr. Franz Schilling (til venstre), Stephan Düwel (i midten) og Christian Hundshammer (th) har udviklet en biosensor, der kan bruges til at vise ændringer i pH -værdien inde i kroppen ved hjælp af MR. -
 Læsning af histonmodifikationer, et onkoprotein modificeres til gengældPæren symboliserer TRIM24, et histone readerprotein, som binder kromatin. Chromatinassociation udløser signalering til TRIM24, markeret eller belyst af en post-translationel modifikation kaldet SUMOyl
Læsning af histonmodifikationer, et onkoprotein modificeres til gengældPæren symboliserer TRIM24, et histone readerprotein, som binder kromatin. Chromatinassociation udløser signalering til TRIM24, markeret eller belyst af en post-translationel modifikation kaldet SUMOyl -
 Udforske, hvad der giver titaniumimplantater deres bemærkelsesværdige biokompatibilitetBåndgab-energierne af den passive film på Ti er relativt små. Det er en faktor, der genererer den fremragende biokompatibilitet. Kredit:Department of Metallic Biomaterials, TMDU Forskere fra Tokyo
Udforske, hvad der giver titaniumimplantater deres bemærkelsesværdige biokompatibilitetBåndgab-energierne af den passive film på Ti er relativt små. Det er en faktor, der genererer den fremragende biokompatibilitet. Kredit:Department of Metallic Biomaterials, TMDU Forskere fra Tokyo -
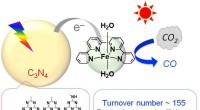 Reduktion af CO2 med fælles elementer og sollysCO 2 reduktion ved anvendelse af en fotokatalysator, der kombinerer carbonnitrid og et jernkompl. Kredit:Osamu Ishitani En international forskningsgruppe, der samarbejder med Tokyo Institute of
Reduktion af CO2 med fælles elementer og sollysCO 2 reduktion ved anvendelse af en fotokatalysator, der kombinerer carbonnitrid og et jernkompl. Kredit:Osamu Ishitani En international forskningsgruppe, der samarbejder med Tokyo Institute of
- Fremstilling af bæredygtige polymerer fra duftende molekyler
- Hvad er det globale miljø?
- Det nukleare brændstof i solen er?
- Sådan konverteres damptryk til koncentration
- Neutroner giver indsigt i øget ydeevne for hybride perovskit-solceller
- Kolonialt folkedrab er en sammensat handling:En menneskerettighedsanalyse


