På grund af polariteten af vandforbindelser, der opløses bedst i, indeholder det?
Her er hvorfor:
* Polaritet: Vandmolekyler har en bøjet form med en lidt positiv ladning på brintsiden og en lidt negativ ladning på iltsiden. Denne ujævne fordeling af ladning gør vand til et polært molekyle.
* "som opløser som": Polære molekyler tiltrækkes af andre polære molekyler, mens ikke -polære molekyler tiltrækkes af andre ikke -polære molekyler. Dette princip opsummeres ofte som "som opløser som."
* opløsningsproces: Når en polær forbindelse tilsættes til vand, tiltrækkes de positive ender af vandmolekyler af de negative ender af de opløste molekyler, og vice versa. Disse attraktioner bryder de opløste molekyler fra hinanden og giver dem mulighed for at opløses i vandet.
Eksempler på polære forbindelser, der opløses godt i vand:
* sukker: Glukose, fruktose, saccharose
* salte: Natriumchlorid (NaCl), kaliumbromid (KBR)
* syrer: Hydrochlorsyre (HCI), eddikesyre (CH3COOH)
* Alkoholer: Ethanol (C2H5OH), methanol (CH3OH)
Eksempler på ikke -polære forbindelser, der ikke opløses godt i vand:
* olier: Vegetabilsk olie, olivenolie
* fedt: Smør, smult
* voks: Bivoks, paraffinvoks
* Gasser: Nitrogen (N2), ilt (O2)
Undtagelser:
Mens "som opløser som" er en god tommelfingerregel, er der nogle undtagelser. For eksempel kan nogle forbindelser med store, ikke -polære sektioner stadig være lidt opløselige i vand på grund af andre faktorer som hydrogenbinding.
 Varme artikler
Varme artikler
-
 En ny gelelektroforese teknik til hurtig biomarkørdiagnose via massespektrometriOpløselige BAC-tværbundne geler muliggør hurtig og tabsfri genvinding af proteinbiomarkører adskilt af SDS-polyacrylamidgelelektroforese og letter analyse ved massespektrometri. Kredit: Journal of Pro
En ny gelelektroforese teknik til hurtig biomarkørdiagnose via massespektrometriOpløselige BAC-tværbundne geler muliggør hurtig og tabsfri genvinding af proteinbiomarkører adskilt af SDS-polyacrylamidgelelektroforese og letter analyse ved massespektrometri. Kredit: Journal of Pro -
 Potentialafhængig afbryder hjælper med vandopdeling ved hjælp af koboltoxid-katalysatorerEn potentialafhængig afbryder hjælper med vandspaltning ved hjælp af cobaltoxid-katalysatorer, Boston College og Yale University-forskere rapporterer i tidsskriftet Chem. Lille elektrisk ladning drive
Potentialafhængig afbryder hjælper med vandopdeling ved hjælp af koboltoxid-katalysatorerEn potentialafhængig afbryder hjælper med vandspaltning ved hjælp af cobaltoxid-katalysatorer, Boston College og Yale University-forskere rapporterer i tidsskriftet Chem. Lille elektrisk ladning drive -
 Knækning af colibactins kode:Undersøgelse undersøger, hvordan sammensatte beskadigede DNA for at …Escherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I mere end et årti, forskere har arbejdet på at forstå sammenhængen mellem colibactin, en forbindelse fremstillet af visse stammer
Knækning af colibactins kode:Undersøgelse undersøger, hvordan sammensatte beskadigede DNA for at …Escherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I mere end et årti, forskere har arbejdet på at forstå sammenhængen mellem colibactin, en forbindelse fremstillet af visse stammer -
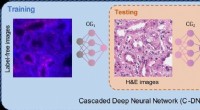 Kemikaliefri genfarvning af væv ved hjælp af dyb læringVirtuel genfarvning af væv ved hjælp af kaskadede dybe neurale netværk. Kredit:Ozcan Lab @ UCLA. Vævsbaseret diagnosticering af sygdomme er afhængig af den visuelle inspektion af biopsierede vævspr
Kemikaliefri genfarvning af væv ved hjælp af dyb læringVirtuel genfarvning af væv ved hjælp af kaskadede dybe neurale netværk. Kredit:Ozcan Lab @ UCLA. Vævsbaseret diagnosticering af sygdomme er afhængig af den visuelle inspektion af biopsierede vævspr
- Beskriv hvordan hastigheden og accelerationen af en genstandsændring, da den faldt fra høj bygni…
- Facebook 3Q-resultater viser vækst i mobilannoncer
- Kan plastik laves af alger?
- Lab skaber ledende 3-d kulstofblokke, der kan formes til applikationer
- Hvilken planet i Mælkevejen er længst fra solen?
- Hvad er den bedste faste stofisolator?


