Ligner lipider vandmolekyler?
Her er en sammenbrud:
Vand:
* polær: Vandmolekyler har en positiv og negativ ende på grund af den ulige deling af elektroner i ilt-hydrogenbindingerne. Denne polaritet tillader vandmolekyler at danne hydrogenbindinger med hinanden, hvilket gør vand sammenhængende og et godt opløsningsmiddel.
* Hydrofil: Vand interagerer let med og opløser andre polære molekyler.
* væske ved stuetemperatur: På grund af hydrogenbinding har vand et relativt højt kogepunkt og er en væske ved typiske temperaturer.
lipider:
* ikke -polær: Lipider er lavet af lange kæder af kulbrinter (kulstof- og brintatomer), der deler elektroner temmelig lige. Dette resulterer i ikke -polære molekyler, der ikke let danner brintbindinger.
* Hydrofob: Lipider afviser vand og opløses ikke i det.
* fast eller flydende afhængigt af struktur og temperatur: Lipider kan være faste (fedt) eller flydende (olier) ved stuetemperatur, afhængigt af længden og mætningen af carbonhydridkæderne.
Her er en analogi:
Tænk på vand som en social sommerfugl, der let interagerer med andre polære molekyler. Lipider er som introverte, der foretrækker at holde sig til andre lipider og undgå vandfesten.
Nøgleforskelle:
* Polaritet: Vand er polære, lipider er ikke -polære.
* opløselighed: Vand er hydrofil (vandelskende), lipider er hydrofobe (vandfryd).
* Intermolekylære kræfter: Vand danner stærke brintbindinger, lipider har svagere van der Waals -styrker.
Denne forskel i egenskaber gør lipider af vitale komponenter i cellemembraner, mens vand er afgørende for de fleste biologiske processer.
Sidste artikelHvad er den enkleste ligning af fotosyntesen?
Næste artikelHvad sker der med vandmoulcule, når der påføres varme?
 Varme artikler
Varme artikler
-
 Forskere udvikler en ny metode til forbedring af effektiviteten af luftrensereLuftrenser. Kredit:Sergei Preis, TalTech Ren luft er noget, vi løbende er stolte af i vores lille Estland, og det er blevet kaldt, dels i sjov, en af de vigtigste eksport. Desværre, miljøet, her
Forskere udvikler en ny metode til forbedring af effektiviteten af luftrensereLuftrenser. Kredit:Sergei Preis, TalTech Ren luft er noget, vi løbende er stolte af i vores lille Estland, og det er blevet kaldt, dels i sjov, en af de vigtigste eksport. Desværre, miljøet, her -
 En rekordlang polymer DNA negativPå Institut for Fysisk Kemi ved Det Polske Videnskabsakademi i Warszawa blev et rekordlangt fragment af DNA indprentet i polymeren. Kredit:IPC PAS, Grzegorz Krzyzewski Et fragment af en enkelt DNA
En rekordlang polymer DNA negativPå Institut for Fysisk Kemi ved Det Polske Videnskabsakademi i Warszawa blev et rekordlangt fragment af DNA indprentet i polymeren. Kredit:IPC PAS, Grzegorz Krzyzewski Et fragment af en enkelt DNA -
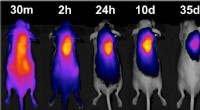 Et hyppelys for kemoterapilægemidlerHos mus, en hydrogel rekrutterer et farvestoffemærket molekyle (farvede områder) til sin placering, viser dets potentiale til at være et hjemfyrtårn for kræftmedicin. Kredit:Tilpasset fra ACS Central
Et hyppelys for kemoterapilægemidlerHos mus, en hydrogel rekrutterer et farvestoffemærket molekyle (farvede områder) til sin placering, viser dets potentiale til at være et hjemfyrtårn for kræftmedicin. Kredit:Tilpasset fra ACS Central -
 Forskere finder en måde at gøre pultrudering hurtigereSkoltech-forskere finder en måde at gøre pultrusion hurtigere. Kredit:Timur Sabirov / Skoltech Et forskerhold fra Skoltech Center for Design, Manufacturing and Materials (CDMM) har undersøgt virkn
Forskere finder en måde at gøre pultrudering hurtigereSkoltech-forskere finder en måde at gøre pultrusion hurtigere. Kredit:Timur Sabirov / Skoltech Et forskerhold fra Skoltech Center for Design, Manufacturing and Materials (CDMM) har undersøgt virkn
- Hvad er formålet med en vakuol i cellen?
- Hvad er en nem måde at konvertere meter til fod?
- Hvad er et materiale, der dannede sig fra forfaldet af gamle organismer og bruges i dag som kildeene…
- Reglerne for uddeling af eksponenter
- NASA analyserer nedbør omkring tyfonen Chan-homs ujævne øjne
- Selvdrevne bilvidenskabelige projekter


