Hvad er sammensætningen af løsning?
opløst: Det stof, der er opløst i opløsningsmidlet. Det er typisk til stede i et mindre beløb end opløsningsmidlet.
opløsningsmiddel: Det stof, der opløser opløsningen. Det er typisk til stede i et større beløb end opløsningen.
Eksempel: I en saltvandopløsning er salt det opløste stof, og vand er opløsningsmidlet.
Koncentration: Mængden af opløst stof, der er til stede i en given mængde opløsning, er kendt som dens koncentration. Der er flere måder at udtrykke koncentration på, herunder:
* Molaritet (M): Mol opløst stof pr. Liter opløsning.
* molalitet (m): Mol opløst stof pr. Kg opløsningsmiddel.
* masseprocent (%): Massen af opløst stof divideret med masse af opløsning, ganget med 100.
* volumenprocent (%): Volumen af opløst stof divideret efter lydstyrke af opløsning, ganget med 100.
* dele pr. million (ppm): Masse af opløst stof pr. Million dele af opløsningen.
Faktorer, der påvirker opløselighed:
* arten af opløst stof og opløsningsmiddel: Lignende kemiske egenskaber, som polaritet, har en tendens til at resultere i større opløselighed.
* Temperatur: Forøgelse af temperaturen øger normalt opløselighed for faste stoffer og gasser, men mindsker opløseligheden for nogle gasser.
* tryk: Øget tryk øger generelt opløseligheden af gasser i væsker.
Typer af løsninger:
* vandige løsninger: Opløsninger, hvor vand er opløsningsmidlet.
* Alkoholiske løsninger: Løsninger, hvor alkohol er opløsningsmidlet.
* gasformige løsninger: Opløsninger, hvor en gas opløses i en anden gas.
Det er vigtigt at bemærke, at sammensætningen af en opløsning kan variere afhængigt af de involverede specifikke stoffer og betingelserne under hvilke de er blandet.
Sidste artikelHvad er en reaktant i den generelle fotosyntese ligning?
Næste artikelNavn 3 Produkter af lysreaktionen?
 Varme artikler
Varme artikler
-
 En lavtemperaturmetode til fremstilling af højtydende termoelektriske materialerMohamad Nugraha (til venstre) og hans gruppeleder, Derya Baran, demonstrere enhedens fleksibilitet. Kredit:KAUST Noget af den enorme mængde spildte energi, som maskiner og enheder udsender som var
En lavtemperaturmetode til fremstilling af højtydende termoelektriske materialerMohamad Nugraha (til venstre) og hans gruppeleder, Derya Baran, demonstrere enhedens fleksibilitet. Kredit:KAUST Noget af den enorme mængde spildte energi, som maskiner og enheder udsender som var -
 Ledende biopolymerer ved hjælp af genanvendte fødevareindustriens biprodukterKredit:Unsplash/CC0 Public Domain Avancerede materialer for nylig offentliggjort resultaterne af Technion-forskere, der skabte ledere, der er relevante for solenergiproduktion, biomedicinsk vide
Ledende biopolymerer ved hjælp af genanvendte fødevareindustriens biprodukterKredit:Unsplash/CC0 Public Domain Avancerede materialer for nylig offentliggjort resultaterne af Technion-forskere, der skabte ledere, der er relevante for solenergiproduktion, biomedicinsk vide -
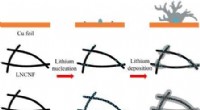 En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science
En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science -
 Låser op for effektiv lys-energikonvertering med stabile koordinationsnanoarkKredit:Hiroshi Nishihara fra Tokyo University of Science To-dimensionelle nanosheets lavet af bindinger mellem metalatomer og organiske molekyler er attraktive kandidater til fotoelektrisk omdanne
Låser op for effektiv lys-energikonvertering med stabile koordinationsnanoarkKredit:Hiroshi Nishihara fra Tokyo University of Science To-dimensionelle nanosheets lavet af bindinger mellem metalatomer og organiske molekyler er attraktive kandidater til fotoelektrisk omdanne


