Hvorfor gasser ædle ikke -reaktive?
* Elektronkonfiguration: Atomer stræber efter at opnå en stabil elektronkonfiguration, som de ædle gasser. Dette betyder at have en fuld ydre skal af elektroner, som er det mest stabile arrangement.
* Valenselektroner: De ydre skalelektroner, kendt som valenselektroner, er involveret i kemisk binding. Noble gasser har en komplet oktet (otte valenselektroner) i deres ydre skal, bortset fra helium, som har en fuld duet (to valenselektroner).
* Ingen grund til at binde: Da de allerede har en stabil elektronkonfiguration, behøver ædle gasser ikke at vinde eller miste elektroner for at danne bindinger med andre atomer. Dette gør dem usædvanligt ureaktive.
Kortfattet: Noble gasser er ikke -reaktive, fordi de har en fuld ydre skal af elektroner, hvilket gør dem iboende stabile og resistente over for dannelse af kemiske bindinger.
Sidste artikelHvad hedder molekylkilden ilt produceret under fotosyntesen?
Næste artikelHvad er udtrykket for ikke kemisk aktiv?
 Varme artikler
Varme artikler
-
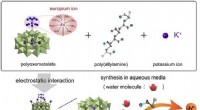 Hybridmateriale flytter næste generations transportbrændstofceller tættere påUltrahøj protonkonduktion i polyoxometalatbaseret ramme Billedtekst:Ultrahøj protonkonduktion via udvidet hydrogenbindingsnetværk i polyoxometalatbaseret ramme, der er funktionaliseret med Lanthanide
Hybridmateriale flytter næste generations transportbrændstofceller tættere påUltrahøj protonkonduktion i polyoxometalatbaseret ramme Billedtekst:Ultrahøj protonkonduktion via udvidet hydrogenbindingsnetværk i polyoxometalatbaseret ramme, der er funktionaliseret med Lanthanide -
 Silkemikrokokoner kunne bruges i bioteknologi og medicinSilkeormen spinder en silkekokon rundt om sig selv for at beskytte sig under metamorfosen. Forskere har fundet ud af, at silke kan beskytte andre dyrebare laster. Kredit:2017 Natural Materials Group
Silkemikrokokoner kunne bruges i bioteknologi og medicinSilkeormen spinder en silkekokon rundt om sig selv for at beskytte sig under metamorfosen. Forskere har fundet ud af, at silke kan beskytte andre dyrebare laster. Kredit:2017 Natural Materials Group -
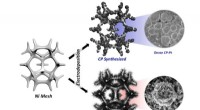 Ny teknik omdanner problemfrit ammoniak til grønt brintKredit:Ulsan National Institute of Science and Technology Et forskerhold ledet af professor Guntae Kim på School of Energy and Chemical Engineering ved UNIST har bebudet et gennembrud inden for te
Ny teknik omdanner problemfrit ammoniak til grønt brintKredit:Ulsan National Institute of Science and Technology Et forskerhold ledet af professor Guntae Kim på School of Energy and Chemical Engineering ved UNIST har bebudet et gennembrud inden for te -
 Membranløse protoceller kunne give spor til dannelsen af tidligt livMembranløse protoceller - kaldet komplekse koacervater - kan samle RNA-molekyler, hvilket gør det muligt for RNAerne at udføre visse reaktioner, et vigtigt skridt i livets oprindelse på Jorden. Billed
Membranløse protoceller kunne give spor til dannelsen af tidligt livMembranløse protoceller - kaldet komplekse koacervater - kan samle RNA-molekyler, hvilket gør det muligt for RNAerne at udføre visse reaktioner, et vigtigt skridt i livets oprindelse på Jorden. Billed
- Hvilken slags syre findes i regn?
- Hvor mange kromosomer er der i en CARPS -kropscelle?
- Hvilken kraft kræves for at holde et objekt med masse 20 kg?
- Cuba lancerer endelig mobil 3G, selvom det er for dyrt for de fleste
- Hvordan NASAs romerske rumteleskop vil beskrive det aktive kosmos
- Sådan registrerer kroppen en essentiel aminosyre


