Sådan registrerer kroppen en essentiel aminosyre
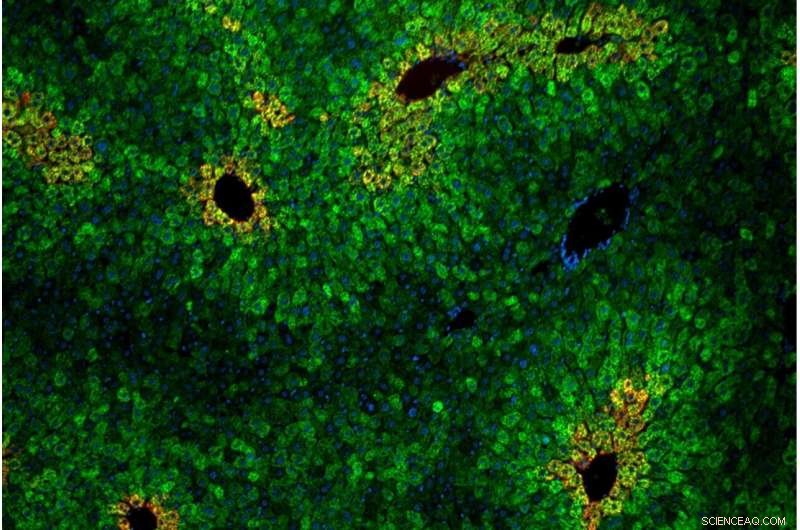
Celler i leveren er arrangeret i "lobuler" af koncentriske ringe af hepatocytter. Leverceller i lobulerne varierer i deres følsomhed over for den essentielle aminosyre leucin. Kredit Andrew Cangelosi/Whitehead Institute
Et nyt papir fra Whitehead Institute-forskere afslører, hvordan mus fornemmer en essentiel aminosyre kaldet leucin, som mange mennesker får fra at spise fisk, æg eller nødder. Undervejs kunne arbejdet informere forskning i at skabe lægemidler, der retter sig mod specifikke dele af en vigtig metabolisk og vækstregulerende vej kaldet mTOR-vejen til behandling af nogle kræftformer eller andre metaboliske sygdomme.
Leucin er nødvendigt for at opbygge og reparere muskler i kroppen; hvis kroppen ikke kan få adgang til denne aminosyre fra mad, er dens bedste fremgangsmåde at lukke for stofskiftet i visse væv, indtil ressourcen er genoprettet. Det er derfor, leucinføling er vigtig – hvis dyrets stofskifte fortsætter med at køre som normalt uden leucin, fandt forskerne ud af, at dyret i det væsentlige vil kannibalisere sig selv og udtømme fedt- og muskellagrene.
Den tidligere Whitehead Institute-forsker Andrew Cangelosi ledede undersøgelsen, mens han færdiggjorde sin ph.d. i laboratoriet hos tidligere Whitehead Institute-medlem David Sabatini. "Folk har vidst i lang tid, at aminosyrer meget stærkt regulerer mTOR-vejen, men da jeg startede i laboratoriet, var det en stor sort boks - vi var lige begyndt at forstå, hvad de lavede, og hvordan det foregik." sagde Cangelosi.
I løbet af de sidste 15 år har forskere - ved Whitehead Institute og andre steder - drillet nogle af mekanismerne for, hvordan aminosyrer påvirker vejen. "En af de store indsigter, der kom fra dette, var, at vejen bekymrede sig om meget specifikke aminosyrer," sagde Cangelosi. Der er 20 aminosyrer, der bruges af pattedyrsceller til at skabe proteiner, og en håndfuld af disse - inklusive leucin - har en meget stærkere effekt på mTOR-vejen end andre aminosyrer.
I et papir fra 2014 opdagede forskere ved Whitehead Institute, at en familie af proteiner kaldet Sestrins var ansvarlige for at kommunikere tilstedeværelsen af leucin til mTOR-vejen, specifikt mTORC1, det næringsstoffølende kompleks. (Proteinet mTOR er en essentiel komponent i to forskellige proteinkomplekser, mTORC1 og mTORC2, som spiller forskellige roller i kroppen. mTORC1, er følsom over for næringsstoffer og styrer proteinsyntese og cellevækst som respons, mens mTORC2 er involveret i cellulær signalering og metabolisk regulering.) I dyrkede celler hæmmer Sestrin1 og Sestrin2 mTORC1-signalering ved at interagere med og undertrykke et proteinkompleks kaldet GATOR2. Når GATOR2 er undertrykt, kan mTOR-vejen ikke forblive aktiv.
Denne forskning fandt sted i cellekultur, men der var stadig spørgsmål om, hvordan denne mekanisme foregik i levende mus. "At studere en homogen cellepopulation i en skål er meget anderledes end i et dyr," sagde han. "Vi ønskede virkelig at forstå, hvad resultaterne i cellekultur betød for, hvad leucin gør i kroppen."
Cangelosi brugte sine kandidatår på at udvikle musemodeller uden Sestrins for at teste, om proteinerne spillede den samme rolle i dyremodeller, som de var i en skål. Derefter fodrede han disse mus, såvel som kontrolmus, med en diæt helt fri for leucin. Når normale mus blev frataget leucin, var de i stand til at kompensere ved at slukke for mTOR-vejen og bremse/standse stofskiftet. Men da mus uden Sestrins (og derfor evnen til at mærke leucin) blev fodret med den leucinfrie diæt, tabte de drastisk fedt og muskelmasse.
Ligesom i cellekultur afhang leucin-sensing-vejen af proteinkomplekset GATOR2 og var specifik for mTORC1 (ikke mTORC2). En ny indsigt fra dyremodellerne var, at leucin-sensing var koncentreret i specifikke områder af leveren. Disse zoner, kaldet leverlobuli, er sekskantede arrangementer af celler, der leder det næringsrige blod fra tarmen gennem leverens filtreringssystem og ind i kroppens kredsløb.
"Leveren ser i det væsentlige alt, hvad du spiser, før resten af din krop gør det," sagde Cangelosi. "Det fungerer som en slags næringsindgang i kroppen, og forskellige celler i leveren har forskellige egenskaber afhængigt af deres arrangement. Det ser bestemt ud til, at kroppen udnytter Sestrinerne til at gøre mTOR-vejen følsom eller ufølsom over for leucin afhængigt af hvor det skal være eller ej."
Indsigten om, at selv i leveren ikke alle celler reagerer på samme måde på leucin tilstedeværelse eller fravær, antyder et mere komplekst syn på denne metaboliske proces, sagde Cangelosi. "Dette peger på en meget ny måde, hvorpå hele banen fungerer i kroppen - at den er forbundet forskelligt i forskellige sammenhænge i forskellige indstillinger, så den cellulære metaboliske funktion faktisk kan dikteres af det specifikke miljø i cellen eller vævet."
Selvom nogle lægemidler er designet til at fremkalde fedttab, understregede Cangelosi, at fedttabet set i leucin-ufølsomme mus ikke er sundt. "Jeg tror ikke, det kan betragtes som gavnligt," sagde han. "mTOR-vejen er en proces til bevarelse af næringsstoffer, som er vigtig, og musene mistede også en masse muskelmasse. Dette er ikke en sund metabolisk omprogrammering - det var en ret dårlig reaktion for musene."
Cangelosis forskning kunne imidlertid informere terapier på andre måder. At forstå, hvordan mTOR-relaterede processer udspiller sig forskelligt i forskellige celletyper, kan i sidste ende føre til behandlinger for nogle kræftformer og andre sygdomme, der påvirker cellemetabolismen. I øjeblikket går mTOR-medikamenter, der er rettet mod lægemidler – specifikt dem, der er baseret på det immunsuppressive lægemiddel rapamycin – ofte i stå i kliniske forsøg på grund af mangel på specificitet.
"Når [mTOR-målrettede lægemidler] gives til mennesker, kommer problemet altid ned på, hvordan de bare så bredt lukker for alt, hvad mTOR gør," sagde Cangelosi. "Hvis vi har en bedre forståelse af, hvordan vi specifikt kan målrette forskellige mTOR-komplekser - og det kan være et langt skud, men hvis vi kan identificere måder at målrette på i specifikke områder af kroppen, endda specifikke celler i kroppen - dvs. vigtige for den givne sygdom eller patologi, som vi forsøger at behandle, ville disse være afgørende for at slippe af med de negative bivirkninger, der har begrænset dette i klinikken så længe."
Forskningen blev offentliggjort i Science .
 Varme artikler
Varme artikler
-
 Timian blandt mandeltræer afbøder klimaændringer og øger jordproduktionenCasestudiet, hvor Diverfarming-projektet eksperimenterer med diversificering af afgrøder i mandeltræ. Kredit:Diverfarming Introduktionen af flerårige afgrøder i gyderne i Middelhavets tørland man
Timian blandt mandeltræer afbøder klimaændringer og øger jordproduktionenCasestudiet, hvor Diverfarming-projektet eksperimenterer med diversificering af afgrøder i mandeltræ. Kredit:Diverfarming Introduktionen af flerårige afgrøder i gyderne i Middelhavets tørland man -
 Sådan fungerer biomimikMenneskelige forsøg på at skabe effektive flyvende maskiner involverede ofte at studere, hvordan fugle flyver. Fabrice Coffrini/AFP/Getty Images Ubåde af den fremtidige fart gennem vandet ved hjælp a
Sådan fungerer biomimikMenneskelige forsøg på at skabe effektive flyvende maskiner involverede ofte at studere, hvordan fugle flyver. Fabrice Coffrini/AFP/Getty Images Ubåde af den fremtidige fart gennem vandet ved hjælp a -
 Ekstra smag og forebyggelse af svindel på menuen for Europas øl- og vinindustriDen europæiske drikkevareindustri vil være foran konkurrenterne ved at forbedre smagen af øl og vin gennem forskning i nye gærstammer. Kredit:Timothy Dykes via Unsplash Europas værdifulde vin- og
Ekstra smag og forebyggelse af svindel på menuen for Europas øl- og vinindustriDen europæiske drikkevareindustri vil være foran konkurrenterne ved at forbedre smagen af øl og vin gennem forskning i nye gærstammer. Kredit:Timothy Dykes via Unsplash Europas værdifulde vin- og -
 Jaguars bevarelse afhænger af naboernes holdningerEn jaguar ved navn Aquiles fanget i et kamerafælde billede taget i Cana, Panama. Den første årsag til jaguardødsfald i Panama er gengældelse for husdyrpredation. Indeslutning af husdyr i korralerne i
Jaguars bevarelse afhænger af naboernes holdningerEn jaguar ved navn Aquiles fanget i et kamerafælde billede taget i Cana, Panama. Den første årsag til jaguardødsfald i Panama er gengældelse for husdyrpredation. Indeslutning af husdyr i korralerne i
- Sådan finder du P-værdier ved hjælp af Texas Instruments TI-83 Calculator
- Store opgraderinger af partikeldetektorer og elektronik forbereder CERN -eksperiment til at streame …
- Fundamenter:Et middel, med mangler, til journalistkrisen
- Blockbuster antitrust-forsøg, der går ud over AT&T, Time Warner
- Ny undersøgelse viser dominans af lokale luftforureningskilder i Delhi
- Sprøjt maling af fiberbind på sår


