Kan molekyler konvertere til en tilstand en anden?
Stater af stof:
* fast: Molekyler er tæt pakket og har faste positioner. De vibrerer, men bevæger sig ikke frit.
* væske: Molekyler er tættere sammen end i en gas, men de kan bevæge sig mere frit.
* gas: Molekyler er langt fra hinanden og bevæger sig tilfældigt med høj kinetisk energi.
Overgange mellem stater:
* smeltning: Solid til væske (tilsætning af varme)
* Frysning: Væske til fast stof (fjernelse af varme)
* kogning/fordampning: Væske til gas (tilsætning af varme)
* kondens: Gas til væske (fjernelse af varmen)
* sublimering: Fast til gas (tilsætning af varme)
* afsætning: Gas til fast (fjernelse af varme)
hvordan det fungerer:
* Energi: Nøglen er, at molekylerne i forskellige tilstande har forskellige niveauer af kinetisk energi (bevægelsesenergi). Tilsætning af varme øger den kinetiske energi, mens fjernelse af varmen mindsker den.
* Intermolekylære kræfter: Kræfterne til tiltrækning mellem molekyler (som hydrogenbindinger, van der Waals -styrker osv.) Spiller også en rolle. Disse kræfter er stærkere i faste stoffer, svagere i væsker og i det væsentlige ubetydelige i gasser.
Eksempler:
* Vand: Is smelter i vand, der fordamper i vanddamp (gas). Kondens drejer vanddamp tilbage til vanddråber.
* Tøris: Fast kuldioxid (tøris) sublimerer direkte i gasformigt kuldioxid.
Vigtig note:
Mens molekyler kan ændre tilstande, forbliver den kemiske sammensætning af selve molekylet typisk den samme under disse overgange. For eksempel forbliver vand (H₂O) H₂O, uanset om det er is, flydende vand eller vanddamp.
 Varme artikler
Varme artikler
-
 Efterligner naturen for programmerbare og adaptive syntetiske materialerIllustration, der viser skemaet af stimuli kontrolleret levende polymerisation. Kredit:Subi George (subijg@gmail.com) Biologiske systemer er virkelig repræsentative for et komplekst makroskopisk f
Efterligner naturen for programmerbare og adaptive syntetiske materialerIllustration, der viser skemaet af stimuli kontrolleret levende polymerisation. Kredit:Subi George (subijg@gmail.com) Biologiske systemer er virkelig repræsentative for et komplekst makroskopisk f -
 Visualisering af kemiske reaktioner på bimetaloverfladerEvolution af overfladestrukturer af PtNi bimetaloverflader under forskellige omgivelsesbetingelser. Kredit:KAIST Katalysatorer er resultatet af kemikere, der søger at opklare molekylernes skønhed
Visualisering af kemiske reaktioner på bimetaloverfladerEvolution af overfladestrukturer af PtNi bimetaloverflader under forskellige omgivelsesbetingelser. Kredit:KAIST Katalysatorer er resultatet af kemikere, der søger at opklare molekylernes skønhed -
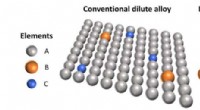 Fremme af multiprincipale legeringer:Forskere udforsker nye domæner af sammensætningsmæssigt komp…Sløring af grænserne mellem majoritets- og minoritetspopulationer af atomarter i en multiprincipal elementlegering (til højre) fører til et robust atomlandskab, åbne nye veje for defekter at navigere.
Fremme af multiprincipale legeringer:Forskere udforsker nye domæner af sammensætningsmæssigt komp…Sløring af grænserne mellem majoritets- og minoritetspopulationer af atomarter i en multiprincipal elementlegering (til højre) fører til et robust atomlandskab, åbne nye veje for defekter at navigere. -
 Bygninger – Beton på det dobbelteORNL forskere brugte fiberforstærkninger lavet af stål, glas og kulstof for at udvikle en betonblanding, der viste høj tidlig styrke inden for seks timer efter produktion, som er nødvendig for den præ
Bygninger – Beton på det dobbelteORNL forskere brugte fiberforstærkninger lavet af stål, glas og kulstof for at udvikle en betonblanding, der viste høj tidlig styrke inden for seks timer efter produktion, som er nødvendig for den præ
- Hvad de eliocentriske og geocentriske modeller af solsystemet inkluderer?
- Forskning udforsker fordele og risici ved pornografi
- Hvilke to lag af jorden er involveret i jordskælv?
- Hvad er den tidligste temperaturmåler?
- Hvilken videnskabsmand brugte sin viden om astronomi til at offentliggøre en populær Almanac?
- Hvordan Seattle bygger vejrforudsigende teknologi til at spotte hedebølger


