Hvordan ændrer pH med temperaturændring?
1. Stoffet i sig selv:
* syrer: For de fleste syrer falder pH med stigende temperatur. Dette skyldes, at ligevægten mellem syren og dens konjugerede base skifter mod den konjugerede base, hvilket fører til en stigning i H+ -ioner og et fald i pH.
* baser: For de fleste baser stiger pH med stigende temperatur. Dette skyldes, at ligevægten mellem basen og dens konjugerede syre skifter mod konjugatsyren, hvilket fører til et fald i OH-ioner og en stigning i pH.
2. Opløsningsmidlet:
* Vand: Autoionisering af vand er en endotermisk proces, hvilket betyder, at den absorberer varme. Når temperaturen stiger, skifter ligevægten for at favorisere produktionen af mere H+ og OH-ioner, hvilket fører til et fald i pH .
3. Tilstedeværelsen af andre stoffer:
* buffere: Buffere modstår ændringer i PH, men deres effektivitet kan påvirkes af temperaturen. Buffersystemets ligevægtskonstant ændres med temperaturen, hvilket kan påvirke pH.
* opløste gasser: Opløseligheden af gasser i vand falder med stigende temperatur. Dette kan påvirke pH af opløsninger, der indeholder opløste gasser som CO2, som danner kulsyre i opløsning.
Kortfattet:
* For de fleste syrer falder pH med stigende temperatur.
* For de fleste baser stiger pH med stigende temperatur.
* pH af rent vand falder med stigende temperatur.
* Effekten af temperatur på pH kan være kompleks og afhænger af det specifikke stof og betingelser.
Vigtig note: Det nøjagtige forhold mellem pH og temperatur er specifikt for hvert stof og opløsning. Det er vigtigt at konsultere relevante data eller udføre eksperimenter for at bestemme den nøjagtige virkning af temperatur på PH for et bestemt system.
 Varme artikler
Varme artikler
-
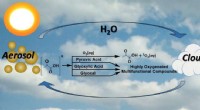 Organiske 2-oxocarboxylsyrer giver forbindelse til dannelse af radikaler og reaktive iltarter i atmo…Vigtig vandig fotokemi af organiske stoffer i atmosfæren. Kredit:Marcelo Guzman Når luftfugtigheden i atmosfæren er relativt høj, partiklerne naturligt til stede, også kendt som aerosoldråber, vok
Organiske 2-oxocarboxylsyrer giver forbindelse til dannelse af radikaler og reaktive iltarter i atmo…Vigtig vandig fotokemi af organiske stoffer i atmosfæren. Kredit:Marcelo Guzman Når luftfugtigheden i atmosfæren er relativt høj, partiklerne naturligt til stede, også kendt som aerosoldråber, vok -
 Forskere udvikler et nyt peptidsystem til målrettet transport af molekyler ind i levende pattedyrce…Kredit:CC0 Public Domain Et nyt peptid udviklet ved universiteterne i Bayreuth og Bristol er fremragende egnet til målrettet transport af molekyler-f.eks. aktive stoffer og farvestoffer-ind i pat
Forskere udvikler et nyt peptidsystem til målrettet transport af molekyler ind i levende pattedyrce…Kredit:CC0 Public Domain Et nyt peptid udviklet ved universiteterne i Bayreuth og Bristol er fremragende egnet til målrettet transport af molekyler-f.eks. aktive stoffer og farvestoffer-ind i pat -
 Multipel myrelignende transport af neuronal last med motorproteinerGodstransport med mange motorer gør neuronal aktivitet fin. Kredit:Kumiko Hayashi Mikrotubuli er veje lavet af proteiner, der strækker sig gennem en celle for motorproteiner (bærere) til at levere
Multipel myrelignende transport af neuronal last med motorproteinerGodstransport med mange motorer gør neuronal aktivitet fin. Kredit:Kumiko Hayashi Mikrotubuli er veje lavet af proteiner, der strækker sig gennem en celle for motorproteiner (bærere) til at levere -
 Forskere opdager ny arkitektur i majsLSU Institut for Kemi Adjunkt Tuo Wang og kolleger er de første til at undersøge en intakt majsplantestilk på atomniveau ved hjælp af højopløsningsteknikker. Kredit:Peggy Greb, USDA Ny forskning i
Forskere opdager ny arkitektur i majsLSU Institut for Kemi Adjunkt Tuo Wang og kolleger er de første til at undersøge en intakt majsplantestilk på atomniveau ved hjælp af højopløsningsteknikker. Kredit:Peggy Greb, USDA Ny forskning i
- Hvordan kan den energi, der er gemt i fotosyntetisk organisme, bruges?
- Videnskaben skal kigge indad for at komme videre
- Er forælderrock forvitrede partikler?
- Forurenende stoffer ændrer hurtigt vandet nær Ieodo Island
- Hvad er det passende kemiske navn for CAI2?
- 6600 yards er lig med hvor mange kilometer?


