Hvorfor er vand et univarsalt opløsningsmiddel?
* Polaritet og hydrogenbinding: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brint) og en lidt negativ ende (ilt). Dette giver dem mulighed for at danne stærke brintbindinger med andre polære molekyler, hvilket effektivt trækker dem fra hinanden.
* opløste mange stoffer: Vand kan opløses mange ioniske forbindelser (som salte) og polære kovalente forbindelser (som sukker). De positive og negative ender af vandmolekyler tiltrækker og omgiver ioner eller polære molekyler, adskiller dem og holder dem opløst.
* begrænset opløsning: Vand er imidlertid ikke et universelt opløsningsmiddel for alt. Det kan ikke opløse ikke-polære stoffer som fedt og olier. Disse molekyler mangler de ladede eller polære regioner, der er nødvendige for at interagere med vandmolekyler.
Her er en bedre måde at tænke på Water's solvens:
* Godt opløsningsmiddel: Vand er et godt opløsningsmiddel for mange stoffer på grund af dets polaritet og evne til at danne brintbindinger.
* ikke et universelt opløsningsmiddel: Det har begrænsninger og kan ikke opløse alle stoffer.
Kortfattet: Vand er et fremragende opløsningsmiddel til en lang række stoffer, men det er ikke rigtigt universelt, fordi det ikke kan opløse ikke-polære forbindelser effektivt.
 Varme artikler
Varme artikler
-
 Generering af strøm fra forurenet luftDen nye enhed må kun udsættes for lys for at rense luft og generere strøm. Kredit:UAntwerpen og KU Leuven Forskere fra University of Antwerpen og KU Leuven (University of Leuven), Belgien, har udv
Generering af strøm fra forurenet luftDen nye enhed må kun udsættes for lys for at rense luft og generere strøm. Kredit:UAntwerpen og KU Leuven Forskere fra University of Antwerpen og KU Leuven (University of Leuven), Belgien, har udv -
 Havsnegleforbindelse reducerer risikoen for kræftDen kræftbekæmpende terapeutiske effekt af Dicathais orbita hypobranchial kirtelekstrakt viser løfte om at modstå kolorektale kræftceller. Kredit:Flinders University Den bemærkelsesværdige evne
Havsnegleforbindelse reducerer risikoen for kræftDen kræftbekæmpende terapeutiske effekt af Dicathais orbita hypobranchial kirtelekstrakt viser løfte om at modstå kolorektale kræftceller. Kredit:Flinders University Den bemærkelsesværdige evne -
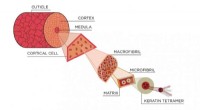 En løsning på et behåret problem inden for retsmedicinMenneskehår består af proteiner kaldet keratiner, der er viklet sammen til en holdbar struktur. Kredit:N. Hanacek/NIST I et forsøg på at gøre hårsammenligning til en mere nyttig teknik til at efte
En løsning på et behåret problem inden for retsmedicinMenneskehår består af proteiner kaldet keratiner, der er viklet sammen til en holdbar struktur. Kredit:N. Hanacek/NIST I et forsøg på at gøre hårsammenligning til en mere nyttig teknik til at efte -
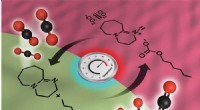 Forskere bekræfter forskellige regioner i populært kulstoffangst og syntese opløsningsmiddelBagsiden af Physical Chemistry Chemical Physics viser et stiliseret billede af de forskellige regioner i SWIL, og hvordan kuldioxiden bevæger sig mellem regionerne baseret på temperatur. Kredit:Mike
Forskere bekræfter forskellige regioner i populært kulstoffangst og syntese opløsningsmiddelBagsiden af Physical Chemistry Chemical Physics viser et stiliseret billede af de forskellige regioner i SWIL, og hvordan kuldioxiden bevæger sig mellem regionerne baseret på temperatur. Kredit:Mike
- Hvilke kemikalier er ingredienser, der bruges i fotosyntesen?
- Hvad er breddegrad og længdegrad på polær iskappe?
- Hvis antallet af kromosomer i hudcelle en organisme er 28, hvilke celler?
- Hvad er fordelene og ulemperne ved at bruge ordinær måling?
- Hvordan gør fotoner sig til overfladen af solen?
- Hvordan man skelner mellem en mand og kvinde Sparrow


