Hvorfor har ikke -polære molekyler ikke modsat opladede mål?
1. Elektronegativitet og binding:
* Elektronegativitet: Dette er et atoms evne i et molekyle til at tiltrække elektroner mod sig selv. Forskellige elementer har forskellige elektronegativiteter.
* polære kovalente obligationer: Når to atomer med signifikant forskellige elektronegativiteter binder, tilbringer de delte elektroner mere tid i nærheden af det mere elektronegative atom. Dette skaber en delvis negativ ladning (Δ-) nær det mere elektronegative atom og en delvis positiv ladning (Δ+) nær det mindre elektronegative atom.
2. Ikke -polære molekyler og afbalanceret ladning:
* ikke -polære molekyler: Disse molekyler dannes fra atomer med lignende elektronegativiteter. Da elektronerne deles forholdsvis jævnt mellem atomerne, er der ingen signifikant ladningsadskillelse. Molekylet er afbalanceret og neutral.
3. Eksempler:
* methan (CH4): Carbon og brint har meget lignende elektronegativiteter. C-H-bindingerne er i det væsentlige ikke-polære. På grund af den symmetriske tetrahedrale form af metan er molekylet som helhed også ikke -polært.
* diatomiske molekyler: Diatomiske molekyler, der består af det samme element (f.eks. Oxygen, O2; nitrogen, N2), er ikke -polære, fordi elektrondelingen er perfekt ens.
Kortfattet:
Ikke -polære molekyler mangler modsat ladede ender, fordi atomerne i dem har lignende elektronegativiteter. Dette fører til en jævn fordeling af elektrondensitet, hvilket resulterer i et molekyle uden nogen signifikant ladningsadskillelse.
 Varme artikler
Varme artikler
-
 3D-udskrivning af den første biomimetiske tungeoverflade nogensindeDen 3D -printede negative form viser huller til filiforme og fungiforme papiller. Kredit:University of Leeds Forskere har skabt syntetiske bløde overflader med tungelignende teksturer for første g
3D-udskrivning af den første biomimetiske tungeoverflade nogensindeDen 3D -printede negative form viser huller til filiforme og fungiforme papiller. Kredit:University of Leeds Forskere har skabt syntetiske bløde overflader med tungelignende teksturer for første g -
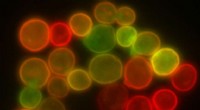 Forskere henter bagergær i jagten på ny medicinGærceller mærket med farverige fluorescerende markører er vist. Kredit:Wikimedia Commons (Public Domain) En af de sværeste dele af opdagelse af lægemidler er at fastlægge, hvordan en medicin fakti
Forskere henter bagergær i jagten på ny medicinGærceller mærket med farverige fluorescerende markører er vist. Kredit:Wikimedia Commons (Public Domain) En af de sværeste dele af opdagelse af lægemidler er at fastlægge, hvordan en medicin fakti -
 Grøn katalyseteknik har til formål at øge effektiviteten af den farmaceutiske fremstillingDiagram af den mikrosfærepakkede, rørreaktor brugt i den nye pseudo-homogene katalyseteknik. Kredit:Milad Abolhasani Omkring 70 procent af lægemidlerne er fremstillet ved hjælp af palladiumdrevne
Grøn katalyseteknik har til formål at øge effektiviteten af den farmaceutiske fremstillingDiagram af den mikrosfærepakkede, rørreaktor brugt i den nye pseudo-homogene katalyseteknik. Kredit:Milad Abolhasani Omkring 70 procent af lægemidlerne er fremstillet ved hjælp af palladiumdrevne -
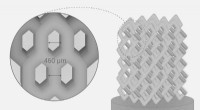 Forskere udviklede en ny metode til fremstilling af knogleimplantaterKnogleimplantat. Kredit:Pavel Odinev / Skoltech Forskere fra Skoltech Center for Design, Fremstilling, and Materials (CDMM) har udviklet en metode til at designe og fremstille kompleksformede kera
Forskere udviklede en ny metode til fremstilling af knogleimplantaterKnogleimplantat. Kredit:Pavel Odinev / Skoltech Forskere fra Skoltech Center for Design, Fremstilling, and Materials (CDMM) har udviklet en metode til at designe og fremstille kompleksformede kera
- Radioaktivt materiale detekteres eksternt ved hjælp af laserinduceret elektronskredbrud
- Hvordan producerer Noctiluca lys?
- Forskere dyrker carbon nanorør med ultra renhed
- Prototypeteknologi til at grave minefelter med ild udviklet af team
- Kan celler transformeres, når de er i en kompetent tilstand?
- Hvad er en levende ting, der producerer en anden som sig selv kaldet?


