Forholdet mellem overfladeareal og reaktionshastighed?
Her er hvorfor:
* flere kontaktpunkter: Et større overfladeareal giver flere kontaktpunkter mellem reaktanterne. Dette betyder, at der er flere muligheder for reaktantmolekyler til at kollidere og interagere, hvilket fører til mere succesrige reaktioner.
* øget hyppighed af kollisioner: Med et større overfladeareal øges hyppigheden af kollisioner mellem reaktantmolekyler, hvilket igen øger sandsynligheden for reaktioner, der forekommer.
* reduceret aktiveringsenergi: I nogle tilfælde kan et større overfladeareal også reducere den aktiveringsenergi, der kræves for at reaktionen skal starte. Dette skyldes, at reaktanterne er lettere tilgængelige på overfladen, hvilket gør det lettere for dem at reagere.
Eksempler:
* pulveriseret sukker vs. sukkerterning: Pulveriseret sukker opløses meget hurtigere i vand end en sukkerterning, fordi den har et meget større overfladeareal udsat for vandet.
* brændende træ: En bunke med træspåner brænder meget hurtigere end en bjælke af træ, fordi spånerne har et meget større overfladeareal udsat for luften.
* katalysatorer: Katalysatorer fungerer ved at tilvejebringe et større overfladeareal for reaktanterne til at interagere på, hvilket øger reaktionshastigheden.
Vigtig note: Dette forhold gælder for heterogene reaktioner , hvor reaktanterne er i forskellige faser (f.eks. Fast og flydende eller fast og gas). I homogene reaktioner , hvor reaktanterne er i samme fase, spiller overfladeareal en mindre betydelig rolle.
 Varme artikler
Varme artikler
-
 Forskere finder en billigere måde at lave brintenergi ud af vandKredit:Shutterstock Brintdrevne biler kan snart blive mere end blot en nyhed, efter at et UNSW-ledet hold af forskere har demonstreret en meget billigere og bæredygtig måde at skabe den brint, der
Forskere finder en billigere måde at lave brintenergi ud af vandKredit:Shutterstock Brintdrevne biler kan snart blive mere end blot en nyhed, efter at et UNSW-ledet hold af forskere har demonstreret en meget billigere og bæredygtig måde at skabe den brint, der -
 Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des
Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des -
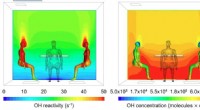 Genovertænker indendørs luftkemiComputermodellering af OH-reaktivitet (venstre) og OH-koncentration (højre) omkring menneskekroppe i en typisk indendørs situation, mens folk sidder omkring et bord. Kredit:UC Irvine Folk bruger ty
Genovertænker indendørs luftkemiComputermodellering af OH-reaktivitet (venstre) og OH-koncentration (højre) omkring menneskekroppe i en typisk indendørs situation, mens folk sidder omkring et bord. Kredit:UC Irvine Folk bruger ty -
 Grøn produktion af kemikalier til industrienBiokatalysator:to forskellige proteiner samler sig selv i en hydrogel, ligner en to-komponent klæbemiddel. Kredit:Grafik:Theo Peschke, SÆT Industrien bruger store mængder råolie til at producere b
Grøn produktion af kemikalier til industrienBiokatalysator:to forskellige proteiner samler sig selv i en hydrogel, ligner en to-komponent klæbemiddel. Kredit:Grafik:Theo Peschke, SÆT Industrien bruger store mængder råolie til at producere b
- Brugen af elektriske ledere og isolatorer
- Hvilken er en førende teori til dannelse af fossile brændstoffer?
- Hvilken bjergkæde blev lavet ved subduktion?
- Woodstock var virkelig en friløbsfestival, viser ny arkæologisk forskning
- Storbritannien spænder for rekordhøje temperaturer
- I dyr, hvilket trin er mere dominerende haploid eller diploid?


