Hvilken ladning til hydrofobe aminosyrer har ved PH6?
Her er hvorfor:
* Hydrofobicitet: Hydrofobe aminosyrer har sidekæder, der ikke er tiltrukket af vand. De foretrækker at være i det indre af proteiner, væk fra det vandige miljø.
* ikke-polære sidekæder: Deres sidekæder har ingen grupper, der let får eller mister protoner (H+ -ioner) til at blive opkrævet.
* ph og ionisering: PH af en opløsning påvirker ioniseringstilstanden for aminosyrer. Ved pH 6 er carboxylgruppen (COOH) af aminosyrer generelt deprotoneret (COO-), og aminogruppen (NH2) protoneres generelt (NH3+). Imidlertid er disse ladninger på rygraden i aminosyren, ikke på sidekæderne af hydrofobe aminosyrer.
Eksempler på hydrofobe aminosyrer:
* Alanin (ala, a)
* Valine (Val, V)
* Leucine (Leu, L)
* Isoleucin (ile, i)
* Proline (pro, p)
* Phenylalanin (Phe, F)
* Tryptophan (TRP, W)
* Methionin (Met, M)
Bemærk: Mens disse aminosyrer typisk er uladet ved pH 6, kan der være nogle små variationer, der er ansvarlige afhængigt af det specifikke proteinmiljø. Deres primære egenskaber er imidlertid deres mangel på en betydelig ladning.
 Varme artikler
Varme artikler
-
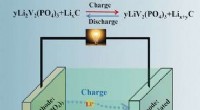 Højhastigheds- og langtidsholdbart lithium-ion-batteri med forbedret ydeevne ved lav temperatur gen…Kredit:Wiley Når det er koldt om vinteren, biler har en tendens til at have startproblemer. Dette er ikke meget bedre med elbiler, som uundgåeligt mister kapaciteten af deres genopladelige lithi
Højhastigheds- og langtidsholdbart lithium-ion-batteri med forbedret ydeevne ved lav temperatur gen…Kredit:Wiley Når det er koldt om vinteren, biler har en tendens til at have startproblemer. Dette er ikke meget bedre med elbiler, som uundgåeligt mister kapaciteten af deres genopladelige lithi -
 Kunstigt sødemiddel kunne en dag give kræftbehandlinger med færre bivirkningerKredit:American Chemical Society Kunstige sødestoffer bruges i diætdrikke og fødevarer, men kan også en dag bruges som behandlinger rettet mod kulsyreanhydrase IX (CA IX), et protein forbundet med
Kunstigt sødemiddel kunne en dag give kræftbehandlinger med færre bivirkningerKredit:American Chemical Society Kunstige sødestoffer bruges i diætdrikke og fødevarer, men kan også en dag bruges som behandlinger rettet mod kulsyreanhydrase IX (CA IX), et protein forbundet med -
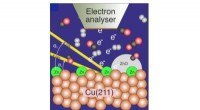 Forskere optrævler den aktive fase i katalytisk kuldioxidreduktion til methanolFigur illustrerer en Cu-overflade dækket med en lille mængde Zn, der er probet med fotoelektronspektroskopi under reaktion af CO2, CO og H2 til methanol. Kredit:Stockholm Universitet Forskere ved S
Forskere optrævler den aktive fase i katalytisk kuldioxidreduktion til methanolFigur illustrerer en Cu-overflade dækket med en lille mængde Zn, der er probet med fotoelektronspektroskopi under reaktion af CO2, CO og H2 til methanol. Kredit:Stockholm Universitet Forskere ved S -
 Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq
Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq
- Hvor mange ækvivalente Lewis-strukturer er nødvendige for at beskrive bindingen i SF2?
- Hvad er organeller, og hvad deres funktioner?
- Når vand bliver varmere, mister det næringsstoffer?
- Hvilken effekt ville tilstedeværelsen af kaliumhydroxid have på fotosyntesen?
- Er ioniske forbindelser, der producerer positive hydrogenioner, når de opløses i vand?
- Forudsigelse af store jordskælv langs Wasatch-fronten, Utah


