Hvilken struktur vil atomer have efter at have mistet eller fået elektroner?
1. Dannelse af ioner:
* taber elektroner: Når et atom mister elektroner, bliver det positivt ladet og danner en kation . Dette skyldes, at antallet af protoner (positiv ladning) nu opvejer antallet af elektroner (negativ ladning).
* At vinde elektroner: Når et atom får elektroner, bliver det negativt ladet og danner en anion . Dette skyldes, at antallet af elektroner (negativ ladning) nu opvejer antallet af protoner (positiv ladning).
2. Elektronisk konfiguration:
* Tab af elektroner: De tabte elektroner er typisk fra det yderste energiniveau (Valence Shell). Dette resulterer i, at atomet opnå en mere stabil elektronkonfiguration, der ofte ligner den nærmeste ædle gas.
* At vinde elektroner: De opnåede elektroner tilføjes typisk til det yderste energiniveau og fylder det op. Dette fører også til en mere stabil elektronkonfiguration, der ofte ligner den nærmeste ædle gas.
3. Størrelsesændring:
* Tab af elektroner: At miste elektroner fører til en mindre atomradius . Dette skyldes, at den positive ladning i kernen nu har et stærkere træk på de resterende elektroner.
* At vinde elektroner: At vinde elektroner fører til en større atomradius . Dette skyldes, at det øgede antal elektroner skaber større elektronelektron-frastødelse, hvilket skubber elektronskyen længere fra kernen.
4. Kemisk reaktivitet:
* ioner: Ioner er meget mere kemisk reaktive end neutrale atomer. Deres afgifter giver dem mulighed for at danne ioniske bindinger med modsat ladede ioner og skabe ioniske forbindelser.
Eksempel:
* natrium (NA): Et natriumatom har et elektron i sin valensskal. Det mister let dette elektron for at blive en natriumion (Na+) og opnå en stabil konfiguration som neon (NE). Den har nu en mindre atomradius og er meget reaktiv og danner ioniske forbindelser.
Konklusion:
Tabet eller forstærkningen af elektroner ændrer grundlæggende strukturen af et atom, hvilket fører til dannelsen af ioner, ændrede elektroniske konfigurationer, størrelsesændringer og øget kemisk reaktivitet. Disse ændringer tillader atomer at deltage i kemisk binding og danne forskellige molekyler og forbindelser.
 Varme artikler
Varme artikler
-
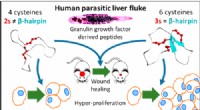 Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l
Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l -
 Kollagen i bruskvæv opfører sig som flydende krystaller på en smartphone-skærmKredit:ACS Brusk i vores led indeholder kollagen, som opfører sig lidt som de flydende krystaller på en smartphones skærm, ifølge forskere ved Queen Mary University of London (QMUL). Kollagenet æ
Kollagen i bruskvæv opfører sig som flydende krystaller på en smartphone-skærmKredit:ACS Brusk i vores led indeholder kollagen, som opfører sig lidt som de flydende krystaller på en smartphones skærm, ifølge forskere ved Queen Mary University of London (QMUL). Kollagenet æ -
 At lave falsk kød rejser spørgsmål om sundhed, etik og bæredygtighed for en tidligere slagterJohannes van Dijk, en ph.d.-studerende ved USC School of Pharmacy, modtog Charles og Charlotte Krown Fellowship for sit arbejde med genteknologi. Kredit:Foto/Eric Lindberg At skabe en laboratoried
At lave falsk kød rejser spørgsmål om sundhed, etik og bæredygtighed for en tidligere slagterJohannes van Dijk, en ph.d.-studerende ved USC School of Pharmacy, modtog Charles og Charlotte Krown Fellowship for sit arbejde med genteknologi. Kredit:Foto/Eric Lindberg At skabe en laboratoried -
 Forskere udvikler dobbeltlags maling, der reflekterer varmeDen dobbeltlagsbelægning forbliver køligere under sollys. Kredit:Jyotirmoy Mandal Et team af forskere fra Columbia og Howard Universiteter i USA og Peking University i Kina har udviklet en slags f
Forskere udvikler dobbeltlags maling, der reflekterer varmeDen dobbeltlagsbelægning forbliver køligere under sollys. Kredit:Jyotirmoy Mandal Et team af forskere fra Columbia og Howard Universiteter i USA og Peking University i Kina har udviklet en slags f
- Hvad er 3 måder, hvorpå mennesker bruger samspillet mellem stof og energi?
- Algoritme til 16 bit bås multiplikator?
- Hvad er den hastighed, hvormed accelerationen af et faldende genstande falder til nul, fordi luftm…
- Ny rekord ved ultrakold neutronkilde i Mainz
- Hvilke dyr spreder frø?
- Forskere måler, hvor sød handlen er for virksomhedspolitiske donorer


