Hvordan er temperaturen på et stof relateret til tiltrækning mellem molekyler og dets tilstande?
1. Temperatur og kinetisk energi:
* Højere temperatur =højere kinetisk energi: Når du opvarmer et stof, øger du den gennemsnitlige kinetiske energi for dets molekyler. Dette betyder, at de bevæger sig hurtigere og vibrerer mere intenst.
* lavere temperatur =lavere kinetisk energi: Når du afkøler et stof, reducerer du den gennemsnitlige kinetiske energi for dets molekyler. De bevæger sig langsommere og vibrerer mindre.
2. Molekylære attraktioner og tilstande af stof:
* fast: I et fast er molekyler tæt pakket og holdes sammen af stærke intermolekylære kræfter (attraktioner mellem molekyler). Disse kræfter er stærke nok til at overvinde molekylernes kinetiske energi og holde dem i en fast, stiv struktur.
* væske: I en væske er molekyler stadig tæt på hinanden, men kræfterne, der holder dem, er svagere end i et fast stof. Molekyler kan bevæge sig rundt og glide forbi hinanden, så væsker kan flyde.
* gas: I en gas er molekyler langt fra hinanden og har meget svage intermolekylære kræfter. Molekylernes kinetiske energi er høj nok til at overvinde enhver attraktion, så de kan bevæge sig frit og fylde enhver beholder, de besætter.
Forholdet:
* Opvarmning af et solidt: Når du øger temperaturen på et fast stof, øger du den kinetiske energi i dens molekyler. Til sidst er energien høj nok til at overvinde de intermolekylære kræfter, der holder dem i en fast struktur. Den faste smelter til en væske.
* Opvarmning af en væske: Når du fortsætter med at øge temperaturen på en væske, øges molekylernes kinetiske energi yderligere. Til sidst er energien høj nok til at overvinde de resterende intermolekylære kræfter, hvilket får væsken til at fordampe til en gas.
* afkøling af en gas: Når du afkøler en gas, falder molekylernes kinetiske energi. Til sidst bremser molekylerne nok til, at intermolekylære kræfter kan blive betydningsfulde. Gassen kondenserer til en væske.
* afkøling af en væske: Når du fortsætter med at afkøle en væske, falder den kinetiske energi yderligere. Til sidst bremser molekylerne nok til at blive holdt i en fast struktur af intermolekylære kræfter. Væsken fryser til et fast stof.
Nøglepunkter:
* Intermolekylære kræfter er vigtige: Styrken af intermolekylære kræfter bestemmer, hvor tæt molekyler holdes sammen og påvirker stoftilstanden.
* Temperatur er et mål for gennemsnitlig kinetisk energi: Det er ikke et mål for det kinetiske energi i ethvert individuelt molekyle, men snarere den gennemsnitlige energi for alle molekyler i stoffet.
* faseændringer er kontinuerlige: Der er ingen skarp linje mellem fast, flydende og gas. I stedet er der overgange mellem dem, når temperaturen ændrer sig.
Denne forklaring hjælper med at forstå, hvordan temperaturen på et stof påvirker bevægelsen af molekyler og bestemmer i sidste ende dens stof.
 Varme artikler
Varme artikler
-
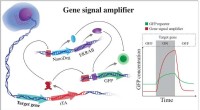 Stærke signaler viser, hvordan proteiner kommer og gårGensignalforstærkeren udviklet af bioscientists ved Rice University udmærker sig ved at detektere ekspressionen af målgener og kan også bruges til at detektere potentielt ethvert cellulært gen. Fors
Stærke signaler viser, hvordan proteiner kommer og gårGensignalforstærkeren udviklet af bioscientists ved Rice University udmærker sig ved at detektere ekspressionen af målgener og kan også bruges til at detektere potentielt ethvert cellulært gen. Fors -
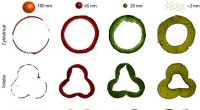 Fluorescerende alkometer gør optimering af katalysatorer meget nemmereFluorescensmikroskopibilleder viser virkningerne af forskellige former på katalysatoraktivitet. Kredit:Utrecht University En ny test for industrielle katalysatorer udviklet af kemikere ved Utrecht
Fluorescerende alkometer gør optimering af katalysatorer meget nemmereFluorescensmikroskopibilleder viser virkningerne af forskellige former på katalysatoraktivitet. Kredit:Utrecht University En ny test for industrielle katalysatorer udviklet af kemikere ved Utrecht -
 MasSpec Pen til nøjagtig kræftdetektion under operationMasSpec-pennen (til venstre) kunne en dag hjælpe kræftkirurger med at bestemme kanterne af tumorer i operationsstuen; forskere brugte det til at analysere skjoldbruskkirtelvæv ex vivo (til højre) og t
MasSpec Pen til nøjagtig kræftdetektion under operationMasSpec-pennen (til venstre) kunne en dag hjælpe kræftkirurger med at bestemme kanterne af tumorer i operationsstuen; forskere brugte det til at analysere skjoldbruskkirtelvæv ex vivo (til højre) og t -
 Nye forbindelser opdaget i marine svampe kan dræbe lægemiddelresistente bakterierFlere stoffer, der dræbte antibiotika-resistente bakterier, blev fundet af brasilianske forskere i en marin svamp hjemmehørende i Fernando de Noronha, en øgruppe ud for kysten i det nordøstlige. Kredi
Nye forbindelser opdaget i marine svampe kan dræbe lægemiddelresistente bakterierFlere stoffer, der dræbte antibiotika-resistente bakterier, blev fundet af brasilianske forskere i en marin svamp hjemmehørende i Fernando de Noronha, en øgruppe ud for kysten i det nordøstlige. Kredi
- Hvad er karakteristika for en forkølelse?
- Forskere får gennembrud i solcellematerialer
- Hvad forårsager skumning i en destillationskolonne?
- NASA sporer den tropiske storm Talim i det filippinske hav
- Hvordan ville en bølgelængde være, hvis afstanden mellem toppene øgedes?
- Hvad er definition af en kerne?


