Hvorfor opløses polære stoffer godt i andre stoffer?
Her er sammenbruddet:
* Polaritet: Polære molekyler har en ujævn fordeling af elektroner, hvilket skaber en lidt positiv ende og en lidt negativ ende. Denne ujævne ladningsfordeling er som en lille magnet, så de kan tiltrække andre polære molekyler. Tænk på vand (H₂O):Oxygenatomet svin elektronerne, hvilket gør det lidt negativt, mens brintatomerne bliver lidt positive.
* "som opløser som": Princippet "som opløser som" siger, at polære stoffer har en tendens til at opløses godt i andre polære stoffer, mens ikke -polære stoffer opløses godt i andre ikke -polære stoffer.
Her er hvorfor:
1. Stærke attraktioner: Polære molekyler danner stærke attraktioner (hydrogenbindinger, dipol-dipolinteraktioner) med andre polære molekyler. Disse attraktioner ligner attraktionerne inden for selve det polære stof.
2. svækkelse af eksisterende obligationer: Når et polært stof tilsættes til et andet polært stof, kan de stærke attraktioner mellem molekylerne af begge stoffer svække de eksisterende bindinger inden for hvert stof, så de kan blande og opløses.
Eksempel:
* vand (H₂O) og sukker (C₁₂H₂₂O₁₁): Vand er et meget polært molekyle. Sukker, mens den indeholder ikke-polære kulstofkæder, har også adskillige polære hydroxylgrupper (-OH). Disse polære grupper tillader sukker at danne stærke attraktioner med vandmolekyler, hvilket fører til dens opløsning.
Omvendt opløses ikke -polære stoffer som olie ikke godt i vand, fordi:
* svage interaktioner: Ikke -polære molekyler har meget svage attraktioner til polære molekyler (van der Waals -kræfter).
* stærkere attraktioner inden for: Ikke -polære molekyler har stærkere attraktioner for hinanden, hvilket gør det vanskeligt for dem at bryde fra hinanden og blande med polære stoffer.
I det væsentlige afhænger et stofs evne til at opløses i en anden af styrken af interaktionerne mellem deres molekyler. Polære stoffer har stærke attraktioner for andre polære stoffer, hvilket fører til god opløselighed, mens ikke -polære stoffer interagerer svagt med polære stoffer, hvilket resulterer i dårlig opløselighed.
 Varme artikler
Varme artikler
-
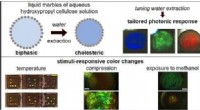 Cellulose:Et altid tilstedeværende materiale med bemærkelsesværdige egenskaberKredit:University of Luxembourg Fysikere fra University of Luxembourg har for nylig taget væsentlige skridt fremad med at løse nogle af de udestående forskningsspørgsmål om cellulose. Deres result
Cellulose:Et altid tilstedeværende materiale med bemærkelsesværdige egenskaberKredit:University of Luxembourg Fysikere fra University of Luxembourg har for nylig taget væsentlige skridt fremad med at løse nogle af de udestående forskningsspørgsmål om cellulose. Deres result -
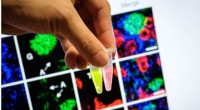 Forskere udvikler sonder til at opdage akut nyresvigt tidligtSonderne, når det tilsættes en urinprøve med biomarkører, der indikerer begyndelsen af akut nyresvigt, lyser, når de udsættes for UV-lys. De gør det 36 timer hurtigere end andre molekylære billeddan
Forskere udvikler sonder til at opdage akut nyresvigt tidligtSonderne, når det tilsættes en urinprøve med biomarkører, der indikerer begyndelsen af akut nyresvigt, lyser, når de udsættes for UV-lys. De gør det 36 timer hurtigere end andre molekylære billeddan -
 Hvedegluten kan bruges til at lave bæredygtigt blematerialeKredit:KTH Royal Institute of Technology Mere bæredygtige bleer er en mulig anvendelse af et nyt biobaseret materiale, som forskere i Sverige er ved at udvikle. Det superabsorberende materiale er
Hvedegluten kan bruges til at lave bæredygtigt blematerialeKredit:KTH Royal Institute of Technology Mere bæredygtige bleer er en mulig anvendelse af et nyt biobaseret materiale, som forskere i Sverige er ved at udvikle. Det superabsorberende materiale er -
 At lave biodiesel af beskidt gammel madolie er blevet meget nemmereSvampelignende katalysatorer kunne transformere biodieselproduktion og kemisk fremstilling. Billedet viser den porøse keramiske svamp fremstillet i undersøgelsen (forstørret 20, 000 gange). Kredit:RMI
At lave biodiesel af beskidt gammel madolie er blevet meget nemmereSvampelignende katalysatorer kunne transformere biodieselproduktion og kemisk fremstilling. Billedet viser den porøse keramiske svamp fremstillet i undersøgelsen (forstørret 20, 000 gange). Kredit:RMI


