Hvad er katalytiske og støkiometriske reagenser?
katalytisk og støkiometriske reagenser:En simpel forklaring
Forestil dig en kemisk reaktion som en dansefest. Du har brug for en katalysator Som en DJ for at få festen i gang, men de deltager faktisk ikke i dansen. På den anden side en støkiometrisk reagens er som en danser, der er vigtig for partiet og vil blive fortæret i processen.
Her er en sammenbrud:
katalytiske reagenser:
* rolle: De letter En reaktion ved at sænke aktiveringsenergien, hvilket betyder, at de gør det lettere og hurtigere, at reaktionen kan ske.
* Beløb: De bruges i små mængder og er ikke konsumeret i reaktionen. De kan bruges gentagne gange.
* Eksempel: Enzymer i biologiske systemer er katalysatorer. De fremskynder biokemiske reaktioner uden at blive brugt op selv.
støkiometriske reagenser:
* rolle: De deltager direkte i reaktionen og forbruges i processen.
* Beløb: De bruges i specifikke mængder Baseret på reaktionens støkiometri.
* Eksempel: I forbrændingen af methan (CH4) er både methan og ilt (O2) støkiometriske reagenser. De reagerer på dannelse af kuldioxid (CO2) og vand (H2O), og de indtages i processen.
Nøgleforskelle:
| Funktion | Katalytisk reagens | Støkiometrisk reagens |
| ------------------- | ----------------------------------------------------------- |
| Rolle | Letter reaktionen | Deltager direkte |
| Forbrug | Ikke konsumeret | Forbruges i reaktionen |
| Anvendt kvantitet | Små beløb | Specifikke mængder |
| Genbrug | Kan genbruges | Ikke genanvendt |
Kortfattet:
* katalysatorer er som DJ: De får tingene i bevægelse, men deltager ikke i festen.
* støkiometriske reagenser er danserne: De er en del af handlingen og bliver brugt op i processen.
At forstå forskellen mellem katalytiske og støkiometriske reagenser er afgørende for at forstå kemiske reaktioner og design af effektive kemiske processer.
 Varme artikler
Varme artikler
-
 Bio-sensing kontaktlinse kunne en dag måle blodsukker, andre kropsfunktionerGennemsigtige biosensorer i kontaktlinser - gjort synlige i denne kunstners gengivelse - kunne snart hjælpe med at spore vores helbred. Kredit:Jack Forkey/Oregon State University Gennemsigtige bio
Bio-sensing kontaktlinse kunne en dag måle blodsukker, andre kropsfunktionerGennemsigtige biosensorer i kontaktlinser - gjort synlige i denne kunstners gengivelse - kunne snart hjælpe med at spore vores helbred. Kredit:Jack Forkey/Oregon State University Gennemsigtige bio -
 Mod en miljøvenlig produktion af aktive farmaceutiske ingredienser med en flowreaktorProf. Dr. Harald Gröger arbejder i ONE-FLOW på en måde at producere kemiske forbindelser gennem kombination af bio- og kemokatalyse i flowreaktorer. De kemiske reaktioner udføres f.eks. I moduler med
Mod en miljøvenlig produktion af aktive farmaceutiske ingredienser med en flowreaktorProf. Dr. Harald Gröger arbejder i ONE-FLOW på en måde at producere kemiske forbindelser gennem kombination af bio- og kemokatalyse i flowreaktorer. De kemiske reaktioner udføres f.eks. I moduler med -
 Tethered chem combos kunne revolutionere kunstig fotosynteseKlik på billedet for at downloade en version i høj opløsning.Brookhaven Lab kemiker Javier Concepcion og Lei Wang, en kandidatstuderende ved Stony Brook University, udtænkt et skema til samling af lys
Tethered chem combos kunne revolutionere kunstig fotosynteseKlik på billedet for at downloade en version i høj opløsning.Brookhaven Lab kemiker Javier Concepcion og Lei Wang, en kandidatstuderende ved Stony Brook University, udtænkt et skema til samling af lys -
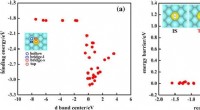 AI ledte efter enkeltatom-legeringskatalysatorer, fundet 200 lovende kandidaterFig. 1:Korrelation mellem simple deskriptorer og målegenskaber. Skoltech-forskere og deres kolleger fra Kina og Tyskland har præsenteret en ny søgealgoritme efter single-atom-legeringskatalysatore
AI ledte efter enkeltatom-legeringskatalysatorer, fundet 200 lovende kandidaterFig. 1:Korrelation mellem simple deskriptorer og målegenskaber. Skoltech-forskere og deres kolleger fra Kina og Tyskland har præsenteret en ny søgealgoritme efter single-atom-legeringskatalysatore
- Hvilken elektricitet produceres ved en generering?
- Et dybt neuralt netværk, der kan maksimere eller minimere farvning for at blande sig ind i eller sk…
- Undersøgelse tyder på, at koralrestaureringsprojekter kan hjælpe med at genoprette fiskesamfund
- Hvad sker der, når et fast stof opvarmes, og temperaturen stiger uden at smelte?
- Hvad sker der med den kinetiske energi fra gaskondensater?
- Hvilke elementer er sikre at blande sammen?


