Hvilket eksperiment gjorde John Dalton for at skabe loven om flere bevaring?
Sådan fungerede det:
1. Tidligere arbejde: Forskere som Joseph Proust havde allerede oprettet loven i bestemte proportioner , der sagde, at en given kemisk forbindelse altid indeholder de samme elementer i de samme proportioner efter masse.
2. Daltons observationer: Dalton observerede, at nogle elementer kunne kombinere i forskellige forhold for at danne forskellige forbindelser. For eksempel kunne carbon og ilt kombineres for at danne både carbonmonoxid (CO) og kuldioxid (CO₂).
3. formulering af loven: Ved at sammenligne forholdet mellem elementer i forskellige forbindelser indså Dalton, at masserne af et element, der kombineres med en fast masse af et andet element, altid er i enkle numberforhold. Dette blev kendt som loven i flere proportioner .
4. Eksempel: I carbonmonoxid (CO) kombineres 12 gram carbon med 16 gram ilt. I kuldioxid (CO₂) kombineres 12 gram carbon med 32 gram ilt. Forholdet mellem iltmasser i de to forbindelser er 16:32, der forenkler til 1:2.
Derfor var "eksperimentet" mere en observation og analyse af eksisterende data. Dalton brugte sin atomteori til at forklare loven i flere proportioner og oplyste, at det var et resultat af elementer, der kombinerede i forskellige hele nummerforhold for atomer. Dette banede vejen for vores forståelse af kemiske reaktioner og sammensætningen af stof.
 Varme artikler
Varme artikler
-
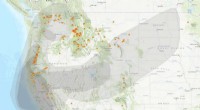 Indånding af brandrøg kan påvirke hjernen og sædcellerne samt lungerneRøg fra store vestlige naturbrande blev opdaget så langt mod øst som Dakotas den 28. august, 2021. Kredit:Interagency Wildland Fire Air Quality Response Program, EPA Skovebrande, der brænder i det
Indånding af brandrøg kan påvirke hjernen og sædcellerne samt lungerneRøg fra store vestlige naturbrande blev opdaget så langt mod øst som Dakotas den 28. august, 2021. Kredit:Interagency Wildland Fire Air Quality Response Program, EPA Skovebrande, der brænder i det -
 Mumbai kan være sårbar over for fremtidige orkanerRegn i Mumbai. Kredit:Flickr -bruger abhijit chendvankar Historisk set, tropiske cykloner (også kendt som orkaner) har sjældent ramt Mumbai, Indien. Men hvordan vil fremtidige storme påvirke denne
Mumbai kan være sårbar over for fremtidige orkanerRegn i Mumbai. Kredit:Flickr -bruger abhijit chendvankar Historisk set, tropiske cykloner (også kendt som orkaner) har sjældent ramt Mumbai, Indien. Men hvordan vil fremtidige storme påvirke denne -
 Forsuring af havet er en udfordring for videnskaben, regeringer og lokalsamfundKredit:CC0 Public Domain Et nyt IMAS-ledet papir offentliggjort i videnskabstidsskriftet Naturens klimaforandringer har fremhævet de udfordringer, forskere står over for, regeringer og lokalsamf
Forsuring af havet er en udfordring for videnskaben, regeringer og lokalsamfundKredit:CC0 Public Domain Et nyt IMAS-ledet papir offentliggjort i videnskabstidsskriftet Naturens klimaforandringer har fremhævet de udfordringer, forskere står over for, regeringer og lokalsamf -
 Medias upartiskhed omkring klimaændringer er etisk vildledende og ligefrem farligKredit:CC0 Public Domain I september 2019, redaktør af Samtalen, Misha Ketchell, erklærede The Conversations redaktion i Australien fremover ved at tage det, han kaldte en nultolerance -tilgang ti
Medias upartiskhed omkring klimaændringer er etisk vildledende og ligefrem farligKredit:CC0 Public Domain I september 2019, redaktør af Samtalen, Misha Ketchell, erklærede The Conversations redaktion i Australien fremover ved at tage det, han kaldte en nultolerance -tilgang ti
- Van Allen-sonderne begynder den sidste fase af udforskningen i Jordens strålingsbælter
- Hvilken form for energi demonstreres af bevægelsespendelen, der svinger frem og tilbage?
- Er en glaskrukke -løsning?
- Hvilken temperaturskala bruges i den videnskabelige undersøgelse af gasser og meget kolde temperatu…
- Hvordan kan metals duktilitet være nyttig?
- Hvordan TFIIH bruger XPG til at lokalisere beskadiget DNA


