Elsker mig, Elsker mig ikke:Forskere opdager ny metode til måling af hydrofobicitet på nanoskalaen

Forskere ved Rensselaerhave har opdaget en ny, mere præcis metode til måling af hydrofobicitet af nanoskala -grænseflader, som kunne have kunne have vigtige anvendelser for fremtiden for opdagelse af lægemidler. Ovenstående snapshot fra en molekylær dynamiksimulering viser et protein (center) indlejret i vand.
(PhysOrg.com) - Forskere ved Rensselaer Polytechnic Institute har opdaget en ny, mere præcis metode til måling af, hvor meget - eller hvor lidt - nanoskala -grænseflader elsker vand.
Undersøgelserne, ledet af Shekhar Garde, Elaine og Jack S. Parker -professor ved Rensselaer og leder af Institut for Kemisk og Biologisk Teknik, blev beskrevet i en serie af tre nylige tidsskriftartikler. Denne nye metode til måling af hydrofobicitet kan have vigtige anvendelser for fremtiden for opdagelse af lægemidler, Sagde Garde.
"Det er let at måle hydrofobicitet i makroskalaen - du lægger bare en dråbe vand på en overflade og ser med dine egne øjne for at se, hvad det gør, ”Sagde Garde. Vandperler op på hydrofobe overflader, såsom et lotusblad eller en nonstick -stegepande, og spredes på hydrofile overflader. Hydrofobicitet måles ved den vinkel, hvormed vanddråben kommer i kontakt med overfladen.
”Men på nanoskalaen, vi kan ikke rigtig lægge en dråbe vand på en proteinoverflade eller på en nanopartikel-som kan være så lille som en milliarddel af en meter i længden-og måle kontaktvinkler, ”Sagde Garde. »Så det er udfordrende at måle, hvor hydrofob eller hydrofil sådan en lille flade egentlig er. Vores nye metode, imidlertid, giver en korrekt og effektiv vej til svaret. ”
De tre artikler blev offentliggjort i Fysisk gennemgangsbreve , Procedurer fra National Academy of Sciences , og som forsiden af denne måneds udgave af American Chemical Society journal Langmuir .
Gardes gruppe udførte omfattende molekylære simuleringer, der modellerede nanoskala-grænseflader kaldet selvsamlede monolag. De modellerede en række hydrofobe og hydrofile overflader, og omhyggeligt overvåget opførsel af vandmolekyler, der har forbindelse til disse overflader. I modsætning til forskernes forventninger, simuleringerne viste, at densiteten af vand ved siden af en overflade er en dårlig måling af hydrofobiciteten af denne overflade. Imidlertid, også uventet, forskerne fandt ud af, at der er en fremragende sammenhæng mellem overfladens hydrofobicitet og udsving i tætheden af det tilstødende vand.
Den nye metode kan føre til en mere robust tilgang til karakterisering af hydrofobicitet af komplekse og heterogene overflader af proteiner, biomolekyler, og andre nanopartikler, Sagde Garde. En sådan tilgang forventes at have vigtige konsekvenser for forståelsen af, hvordan proteiner interagerer med hinanden, og hvordan de binder sig til mål. Den nye metode kan potentielt øge de nuværende beregningsmetoder til screening og design af lægemidler til behandling af en række sygdomme markant, Sagde Garde.
De fleste af Gardes molekylære simuleringer blev udført på Rensselaer Computational Center for Nanotechnology Innovations (CCNI).
Medforfattere af de tre journalpapirer omfatter kemisk og biologisk ingeniørstuderende Sumanth N. Jamadagni, sammen med kemiske og biologiske ingeniørstuderende Sapna Sarupria og Rahul Godawat.
Leveret af Rensselaer Polytechnic Institute (nyheder:web)
Sidste artikelLasere bruges til at lave første bor-nitrid nanorørgarn (m/ video)
Næste artikelEt (nano-) vindue der vasker sig selv?
 Varme artikler
Varme artikler
-
 Lignende nanomaterialer opfører sig forskelligt, men hvorforSuperposition af to dobbeltvæggede nanorør med forskellig strukturel konformation efter de relative chiraliteter:monokiral (intern nanorør) og polychiral (ekstern nanorør) Kredit:SISSA/CNR IOM Nan
Lignende nanomaterialer opfører sig forskelligt, men hvorforSuperposition af to dobbeltvæggede nanorør med forskellig strukturel konformation efter de relative chiraliteter:monokiral (intern nanorør) og polychiral (ekstern nanorør) Kredit:SISSA/CNR IOM Nan -
 Ny algoritme kan opdage materialer med usædvanlige egenskaber – inklusive usynlighedMed denne algoritme, vi kan designe nye metamaterialeegenskaber efter behov, sagde Liu, en adjunkt i maskin- og industriteknik. Kredit:Adam Glanzman/Northeastern University Metamaterialer er kuns
Ny algoritme kan opdage materialer med usædvanlige egenskaber – inklusive usynlighedMed denne algoritme, vi kan designe nye metamaterialeegenskaber efter behov, sagde Liu, en adjunkt i maskin- og industriteknik. Kredit:Adam Glanzman/Northeastern University Metamaterialer er kuns -
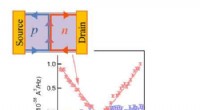 Elektronopdelingsproces i grafen observeret, en verdensnyhedFigur 1. Resultat af skudstøjen målt i vores enhed. Ikke-nul skudstøj på grund af elektronpartitionsprocessen observeres i p-n-junction-tilfældet (røde prikker). På den anden side, der forekommer inge
Elektronopdelingsproces i grafen observeret, en verdensnyhedFigur 1. Resultat af skudstøjen målt i vores enhed. Ikke-nul skudstøj på grund af elektronpartitionsprocessen observeres i p-n-junction-tilfældet (røde prikker). På den anden side, der forekommer inge -
 En nytænkt fremtid for bæredygtige nanomaterialerForskere foreslår en ny metode til valg af nanomaterialer, der inkorporerer miljømæssige og funktionelle præstationer, samt omkostninger. Kredit:Steve Geringer Konstruerede nanomaterialer har et s
En nytænkt fremtid for bæredygtige nanomaterialerForskere foreslår en ny metode til valg af nanomaterialer, der inkorporerer miljømæssige og funktionelle præstationer, samt omkostninger. Kredit:Steve Geringer Konstruerede nanomaterialer har et s
- Nano-diske udgør en potentiel sundhedsrisiko
- Tag en 3D-tur på Mars, og følg NASAs Perseverance-rover
- Ved hjælp af et DNA -stillads til at placere molekyler med Bohrs radiusopløsning
- NIST præsenterer den første test i den virkelige verden af nye designs til røggasemissioner
- Spektr-RG-rumfartøjet registrerer sine første tidevandsforstyrrelser
- Ombord på det første rumfartøj til de trojanske asteroider - NASA Ralphs næste eventyr


