Forskere kvantificerer nanopartikel-protein-interaktioner
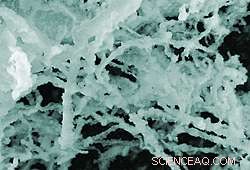
Insulin, et af de mest almindelige proteiner i humant blod, kan akkumulere til fibrøse masser, når den folder forkert. Forskning fra et hold ved NIST viser, at guldnanopartikler tilsyneladende øger insulins tendens til at danne disse fibre. (Farve tilføjet for klarhedens skyld.) Kredit:NIST
(PhysOrg.com) - Et forskerhold ved National Institute of Standards and Technology har kvantificeret samspillet mellem guldnanopartikler og vigtige proteiner, der findes i humant blod, en tilgang, der bør være nyttig i udviklingen af nanopartikel-baserede medicinske terapier og for bedre at forstå den fysiske oprindelse af toksiciteten af visse nanopartikler.
Nanopartikler viser løfte som midler til levering af lægemidler, som medicinske diagnostiske værktøjer, og som kræftbehandlingsmiddel i sig selv. Guld nanopartikler, kugler, der varierer i størrelse mellem 5 og 100 milliardtedele meter i diameter, er især nyttige på grund af de mange måder, deres metaloverflader kan "funktionaliseres" ved at fastgøre skræddersyede molekyler til at udføre forskellige opgaver i kroppen. Imidlertid, behandlinger kræver et stort antal partikler, der skal sprøjtes ind i blodbanen, og disse kan være farlige, hvis de interagerer med kroppen på uforudsete måder.
Ifølge NIST-materialeforsker Jack Douglas, et af de vigtigste problemer, som nanomedicin står over for, er proteinernes tendens til at klæbe til de nanopartikler, der flyder frit i blodbanen. "Nanopartikler belagt med proteiner vil generelt ændre deres interaktion med kroppen, og nanopartiklerne kan forventes at inducere en komplementær ændring i proteinkemisk aktivitet, siger Douglas. "Belægningen kan også få nanopartiklerne til at klumpe sig sammen i store aggregater, som kan fremkalde en enorm immunreaktion. Selvfølgelig, det er noget, du gerne vil undgå."
Forskere har en dårlig forståelse af disse interaktioner, så NIST-holdet besluttede at undersøge, hvad der sker, når nanopartikler af forskellig størrelse støder på fem almindelige blodproteiner. Ved hjælp af et væld af mikroskoper og spektroskopiapparater, holdet fandt flere generelle adfærdsmønstre. "Når først proteinerne klæber til nanopartiklerne, de optiske egenskaber af både partiklerne og proteinerne ændres, " siger Douglas. "At måle disse ændringer hjælper os med at kvantificere klæbrigheden af nanopartiklerne for proteinerne, tykkelsen af det adsorberede proteinlag og partiklernes tilbøjelighed til at aggregere på grund af tilstedeværelsen af proteinlagene."
Mere specifikt, holdet lærte, at alle fem proteiner holdt sig til guldet, får NP'erne til at aggregere, og at forøgelse af kuglernes diameter øgede deres klæbrighed. De fandt også ud af, at denne aggregering normalt forårsagede en ændring i formen af proteinerne - "hvilket generelt også indebærer en ændring i deres funktion, " siger Douglas.
Aggregation fører ikke altid til en giftig reaktion, Douglas siger, men kan påvirke, om stofferne på nanopartiklerne nogensinde når deres tilsigtede mål. "Det vigtigste er, at interaktioner i høj grad bestemmes af eksistensen af proteinlaget, " han siger. "Du vil vide noget om disse proteinlag, hvis du vil vide, hvad nanopartikler kommer til at gøre i kroppen."
Douglas siger, at NIST-undersøgelsen adresserer metrologibehov, der er identificeret i en rapport fra National Research Council** offentliggjort i det forløbne år, der opfordrer til mere kvantitativ testning for nanopartikel-interaktioner med biologiske medier, og at der er behov for meget mere arbejde langs denne og andre linjer. "For eksempel, vi forstår endnu ikke, hvordan partikler af forskellig størrelse binder sig til cellers overflademembraner, hvor mange lægemiddelinteraktioner finder sted, " han siger.
Sidste artikelNanopartikel-cocktail målretter og dræber tumorer
Næste artikelUdnyttelse af divaerne i Nanoworld
 Varme artikler
Varme artikler
-
 Små halvledende krystaller viser løfte for solcellearkitekturer og lysemitterende enhederPerovskit nanotråde har vist sig at fungere som form-korrelerede stabile lysgivere. Kredit:The Ames Laboratory Ames Laboratory-forskere opdagede halvledende nanokrystaller, der ikke kun fungerer s
Små halvledende krystaller viser løfte for solcellearkitekturer og lysemitterende enhederPerovskit nanotråde har vist sig at fungere som form-korrelerede stabile lysgivere. Kredit:The Ames Laboratory Ames Laboratory-forskere opdagede halvledende nanokrystaller, der ikke kun fungerer s -
 Præsident Obama vil blive præsenteret for uafhængighedserklæringer i nanostørrelseChip indeholdende amerikanske og israelske uafhængighedserklæringer, på Jerusalems sten. Ved en ceremoni, der afholdes onsdag d. 20. marts, i Jerusalem, Den israelske premierminister Benjamin Neta
Præsident Obama vil blive præsenteret for uafhængighedserklæringer i nanostørrelseChip indeholdende amerikanske og israelske uafhængighedserklæringer, på Jerusalems sten. Ved en ceremoni, der afholdes onsdag d. 20. marts, i Jerusalem, Den israelske premierminister Benjamin Neta -
 Hvordan fotonik kan omforme lysspektret, og rehabiliter Edisons pære undervejsEn nanofotonisk glødepære demonstrerer evnen til at skræddersy lys udstrålet af en varm genstand. Kredit:MIT Traditionelle pærer, menes at være godt på vej til glemslen, kan få udsættelse takket v
Hvordan fotonik kan omforme lysspektret, og rehabiliter Edisons pære undervejsEn nanofotonisk glødepære demonstrerer evnen til at skræddersy lys udstrålet af en varm genstand. Kredit:MIT Traditionelle pærer, menes at være godt på vej til glemslen, kan få udsættelse takket v -
 En matematisk ligning, der forklarer nanoskums opførselDette er nanoskum. Kredit:UC3M Et forskningsstudie, deltaget i af Universidad Carlos III de Madrid (UC3M), har opdaget, at skumstrukturer i nanometrisk størrelse følger de samme universelle love,
En matematisk ligning, der forklarer nanoskums opførselDette er nanoskum. Kredit:UC3M Et forskningsstudie, deltaget i af Universidad Carlos III de Madrid (UC3M), har opdaget, at skumstrukturer i nanometrisk størrelse følger de samme universelle love,
- Udforskning af et unikt materiale med justerbare egenskaber
- En mikrolaser, der udsender spiralformet lys
- Japansk, Amerikanske astronauter afslutter rumvandring for at reparere robotarm (opdatering)
- Sådan beregnes hastigheden af faldende objekt
- Ny forbindelse effektiv mod lægemiddelresistente patogener, kan føre til nye antibiotika
- Video:Verdens vanddag – hvad har rummet med det at gøre?


