Ny udvikling inden for nanoteknologi tackler de to største problemer forbundet med kemoterapi
Huixin He, lektor, nanoskala kemi ved Rutgers University, Newark, og Tamara Minko, professor ved Rutgers Ernest Mario School of Pharmacy, har udviklet en nanoteknologisk tilgang, der potentielt kan fjerne problemerne med bivirkninger og lægemiddelresistens i behandlingen af kræft. Under traditionel kemoterapi, kræftceller, som bakterier, kan udvikle resistens over for lægemiddelterapi, fører til et tilbagefald af sygdommen.
Som rapporteret i 21. december, 2009, udgave af tidsskriftet Lille , Han, Minko og deres medforskere, inklusive efterforskere fra Merck &Co. og Carl Zeiss SMT, et globalt nanoteknologifirma, har designet nanomaterialer, der muliggør målrettet og samtidig levering af et kemisk lægemiddel til at ødelægge kræftceller og et genetisk lægemiddel for at forhindre lægemiddelresistens.
"Vi modificerede overfladen af mesoporøse silicananopartikler, så et lægemiddel mod kræft, doxorubicin, kunne indlæses i porerne i silicananopartiklerne. Også indlæst på nanopartiklerne var et genetisk lægemiddel designet til at forhindre eller fjerne multilægemiddelresistens uden for nanopartiklerne, " forklarede han.
Når det administreres til multiresistente ovariecancerceller, nanopartikelbehandlingen var mere end 130 gange mere dødelig, end når doxorubicin blev administreret alene. Mest vigtigt, "stoffet kan kun frigives, når det er inde i kræftcellerne. Denne kontrollerede interne frigivelsesmekanisme kan dramatisk eliminere bivirkninger forbundet med kræftlægemidler til normale væv, " bemærkede han.
Kæmper aggressiv brystkræft med nanorør
I beslægtet forskning, Professor He og et andet team af medforskere har udviklet enkeltvæggede kulstof nanorør, bestående af kulstofcylindre på ca. en nanometer i længden, som rummer potentialet til at give et mere effektivt middel til at opdage og selektivt ødelægge aggressive brystkræftceller.
I et papir offentliggjort i BMC Cancer sidst sidste år, forskerne viste, at ved kemisk at binde et specielt antistof til nanorørene og udnytte to unikke optiske egenskaber ved kulstofnanorør (stærk Raman-spredning og nær infrarød absorption), enkelte kræftceller kan påvises og selektivt udryddes, mens de nærliggende normale celler efterlades uskadte. En unikhed ved denne tilgang er, at den giver den fordel, at den lettere kan udvides til andre typer kræftceller. Hans forskning inden for kræftopdagelse og behandling er delvist finansieret med bevillinger fra National Science Foundation og National Cancer Institute.
Forskning fokuserer på praktiske anvendelser på tværs af en bred vifte af felter
Anvendelsen af He's nanoteknologiske forskning er vidt og bredt. I anden forskning, Han og medlemmer af hendes laboratorium på Rutgers arbejder på den praktiske anvendelse af nanomaterialer som et molekylært diagnostisk værktøj til Parkinsons sygdom. Anden forskning er fokuseret på udviklingen af en platform til at opdage tilstedeværelsen af kemiske krigsførelsesmidler til hjemlandsforsvar. Og i endnu anden forskning, Han og hendes laboratoriemedlemmer arbejder på nanoteknologi til præcist og selektivt at måle jernioner (Fe 3+ ) i fjerntliggende havatmosfære støv og havvand, hvilket er afgørende for undersøgelsen af drivhusgasser og klimaændringer.
Hos Rutgers, Han underviser på et bachelorkursus i analytisk kemi og kandidatkurser i elektrokemisk analytisk kemi og et nyt kursus hun har designet i scanning probe mikroskopi. Hun er modtager af 2009 Rutgers Presidential Fellowship for Teaching Excellence.
 Varme artikler
Varme artikler
-
 Blød tryksensor gennembrud løser felternes mest udfordrende flaskehalsMedicinsk sensorteknologi har taget store fremskridt i de seneste år, med udviklingen af bærbare enheder, der kan spore puls, hjernens funktion, biomarkører i sved og mere. Imidlertid, der er et sto
Blød tryksensor gennembrud løser felternes mest udfordrende flaskehalsMedicinsk sensorteknologi har taget store fremskridt i de seneste år, med udviklingen af bærbare enheder, der kan spore puls, hjernens funktion, biomarkører i sved og mere. Imidlertid, der er et sto -
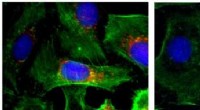 Ny nanopartikelteknologi udviklet til at behandle aggressiv kræft i skjoldbruskkirtlenImmunfluorescensbilleder af celler (kerner vist i blåt; actin vist med grønt; BRAF vist i rødt). Venstre:kontrol; højre:efter behandling med nanopartikler, der dæmper BRAF. Kredit:Jinjun Shi, Brigham
Ny nanopartikelteknologi udviklet til at behandle aggressiv kræft i skjoldbruskkirtlenImmunfluorescensbilleder af celler (kerner vist i blåt; actin vist med grønt; BRAF vist i rødt). Venstre:kontrol; højre:efter behandling med nanopartikler, der dæmper BRAF. Kredit:Jinjun Shi, Brigham -
 Forskere siger, at det første kig på ferroelektriske nanokrystaller på atomare skala peger på te…Dette er et billede i atomopløsning af germanium tellurid nanopartikler fra Berkeley Labs TEAM I elektronmikroskop ved National Center for Electron Microscopy. Kredit:Billede udlånt af Lawrence Berkel
Forskere siger, at det første kig på ferroelektriske nanokrystaller på atomare skala peger på te…Dette er et billede i atomopløsning af germanium tellurid nanopartikler fra Berkeley Labs TEAM I elektronmikroskop ved National Center for Electron Microscopy. Kredit:Billede udlånt af Lawrence Berkel -
 Ændring af eksisterende nitril latex med magnetit nanopartikelNanomag gyllepilotanlæg. Kredit:NANOCAT Den foreliggende opfindelse tilvejebringer en fremgangsmåde til fremstilling af nanopartikelopslæmning af sort jernoxid med en magnetitstruktur og homogent
Ændring af eksisterende nitril latex med magnetit nanopartikelNanomag gyllepilotanlæg. Kredit:NANOCAT Den foreliggende opfindelse tilvejebringer en fremgangsmåde til fremstilling af nanopartikelopslæmning af sort jernoxid med en magnetitstruktur og homogent
- Sådan tilføjes skat til en pris
- Lunar Gateway vil bevare sin bane med en 6 kW ionmotor
- Flydende vand ved 170 grader Celsius:Røntgenlaser afslører unormal dynamik ved ultrahurtig opvarmn…
- Havbaserede handlinger kan lukke huller i afbødning af klimaændringer
- Forskere løser mysteriet med uforklarlige lyse nætter
- En vision for skabelsen af 6G-kommunikation


