Ny nanopartikelteknologi udviklet til at behandle aggressiv kræft i skjoldbruskkirtlen
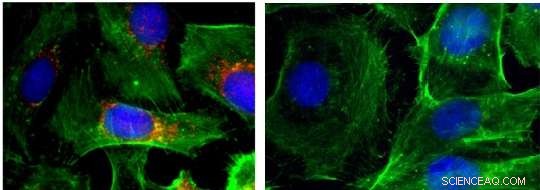
Immunfluorescensbilleder af celler (kerner vist i blåt; actin vist med grønt; BRAF vist i rødt). Venstre:kontrol; højre:efter behandling med nanopartikler, der dæmper BRAF. Kredit:Jinjun Shi, Brigham and Women's Hospital
Anaplastisk skjoldbruskkirtelkræft (ATC), den mest aggressive form for skjoldbruskkirtelkræft, har en dødelighed på næsten 100 procent og en median overlevelsestid på tre til fem måneder. En lovende strategi til behandling af disse solide tumorer og andre er RNA-interferens (RNAi) nanoteknologi, men levering af RNAi-midler til tumorstederne har vist sig udfordrende. Efterforskere på Brigham and Women's Hospital, sammen med samarbejdspartnere fra Massachusetts General Hospital, har udviklet en innovativ nanoplatform, der giver dem mulighed for effektivt at levere RNAi-midler til kræftsteder og undertrykke tumorvækst og reducere metastaser i prækliniske modeller af ATC. Deres resultater vises i denne uge Proceedings of the National Academy of Sciences .
"Vi kalder dette en 'teranostisk' platform, fordi det bringer en terapi og en diagnostik sammen i en funktionel nanopartikel, " sagde co-senior forfatter Jinjun Shi, PhD, adjunkt i anæstesi i Anæstesiafdelingen. "Vi forventer, at denne undersøgelse vil bane vejen for udviklingen af teranostiske platforme til billedstyret RNAi-levering til fremskredne kræftformer."
RNAi, hvis opdagelse vandt Nobelprisen i fysiologi eller medicin for 10 år siden, giver forskere mulighed for at dæmpe muterede gener, herunder dem, som kræftformer er afhængige af for at vokse og overleve og metastasere. Mange ATC'er afhænger af mutationer i det almindeligt muterede cancergen BRAF. Ved at levere RNAi-midler, der specifikt målretter og dæmper dette muterede gen, efterforskerne håbede at stoppe både væksten og spredningen af ATC, som ofte metastaserer til lungerne og andre organer.
Når RNAi leveres alene, det nedbrydes normalt af enzymer eller filtreres ud af nyrerne, før det når tumorceller. Selv når RNAi-midler når så langt som til tumoren, de er ofte ude af stand til at trænge ind eller bliver afvist af kræftcellerne. For at overvinde disse barrierer, efterforskerne brugte nanopartikler til at levere RNAi-molekylerne til ATC-tumorer. Ud over, de koblede nanopartiklerne med en nær-infrarød fluorescerende polymer, hvilket gjorde det muligt for dem at se, hvor nanopartiklerne akkumulerede i en musemodel af ATC.
Ved at måle gløden fra den nær-infrarøde fluorescerende polymer, holdet bekræftede, at nanopartikler havde nået det primære sted for ATC i skjoldbruskkirtlen. Holdet fandt ud af, at nanopartiklerne cirkulerede i lange perioder i blodbanen og akkumulerede i høje koncentrationer i tumorerne.
Ud over, holdet rapporterer beviser på, at BRAF var blevet bragt til tavshed på disse steder. De fandt ud af, at for celler dyrket i en skål og behandlet med nanopartikler, der indeholder RNAi-midler, cellevæksten blev drastisk bremset, og antallet af kræftceller, der var i stand til at migrere, faldt med så meget som 15 gange. I musemodeller, tumorvæksten blev også bremset, og der blev dannet færre metastaser.
For at omsætte den nye platform til kliniske applikationer, forskerholdet bemærker vigtigheden af at have en billeddiagnostik, der giver dem mulighed for hurtigt at vurdere, hvilke patienter der er mest tilbøjelige til at drage fordel af RNAi nanoterapeutika.
"De fleste patienter, der præsenterer sig for kirurger med anaplastisk kræft i skjoldbruskkirtlen, er ude af muligheder, og denne nye forskning giver disse patienter nogle muligheder. At have en tilgang, der giver os mulighed for hurtigt at visualisere og samtidig levere en målrettet behandling kan være afgørende for effektiv behandling af denne sygdom og andre dødelige kræftformer med dårlig prognose, " sagde co-senior forfatter, Sareh Parangi, MD, lektor i MGH Kirurgisk Afdeling.
 Varme artikler
Varme artikler
-
 Sweet spot i sødt materiale til brintlagringTusinder af timers beregninger på Rice Universitys to hurtigste supercomputere fandt ud af, at den optimale arkitektur til at pakke brint ind i hvid grafen involverer at lave skyskraberlignende rammer
Sweet spot i sødt materiale til brintlagringTusinder af timers beregninger på Rice Universitys to hurtigste supercomputere fandt ud af, at den optimale arkitektur til at pakke brint ind i hvid grafen involverer at lave skyskraberlignende rammer -
 To forskellige kollektive oscillationer af elektroner, der forekommer på guldnanopartikler, observe…Fig. 1 (a) Diagram af målesystemet til at observere henfaldsprocessen af elektronens kollektive bevægelse. Laserstrålen til fotoemissionselektronmikroskopet er opdelt i to, og ved at forsinke tiden
To forskellige kollektive oscillationer af elektroner, der forekommer på guldnanopartikler, observe…Fig. 1 (a) Diagram af målesystemet til at observere henfaldsprocessen af elektronens kollektive bevægelse. Laserstrålen til fotoemissionselektronmikroskopet er opdelt i to, og ved at forsinke tiden -
 Metal nanopartikler til billeddiagnostik guidet fototerapiFiguren beskriver billeddannelsesevnen og den antibakterielle aktivitet af Au-Ag nanopartikler. Au-Ag nanopartiklerne, som er positivt ladede, aggregerer på negativt ladede bakterielle cellevægge. De
Metal nanopartikler til billeddiagnostik guidet fototerapiFiguren beskriver billeddannelsesevnen og den antibakterielle aktivitet af Au-Ag nanopartikler. Au-Ag nanopartiklerne, som er positivt ladede, aggregerer på negativt ladede bakterielle cellevægge. De -
 Lille grafentromle kunne danne fremtidig kvantehukommelseKredit:Delft University of Technology Forskere fra TU Delfts Kavli Institut for Nanovidenskab har demonstreret, at de kan registrere ekstremt små ændringer i position og kræfter på meget små troml
Lille grafentromle kunne danne fremtidig kvantehukommelseKredit:Delft University of Technology Forskere fra TU Delfts Kavli Institut for Nanovidenskab har demonstreret, at de kan registrere ekstremt små ændringer i position og kræfter på meget små troml
- Mennesker oplever 200 gange mere stråling stående på månen end stående på jorden
- Forskning undersøger virkningerne af mobiltelefoner for Masai-kvinder
- Antibiotikaresistens i miljøet forbundet med fækal forurening
- Tang-kaffekopper kunne hjælpe med at fjerne engangsplastik
- Sådan fungerer termisk energi
- Små filtre, store nyheder:Ny proces bruger grafen- og bornitrid-monolag til at adskille hydrogenion…


