Forskere bruger plasmoniske nanobobler i levende organismer til at opdage, eliminere prostatakræftceller (m/ video)
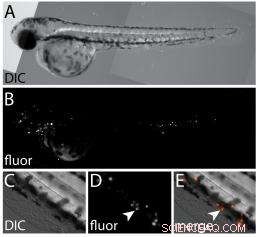
Et sæt billeder viser:A) et differentielt interferenskontrast (DIC) hvidt lysbillede af zebrafiskembryo mærket med fluorescerende humane prostatacancerceller; B) et fluorescerende billede af embryoet i A, afsløring af de xenotransplanterede kræftceller; C) et DIC-billede med høj forstørrelse af den ventrale halefinne; D) et fluorescerende billede af den samme region i C, der afslører xenotransplanterede celler (pilespids); og E) et fusioneret billede af C og D. (Kredit:Wagner Lab/Rice University)
(PhysOrg.com) - Fysikeren Rice University Dmitri Lapotko har demonstreret, at plasmoniske nanobobler, genereret omkring guld nanopartikler med en laserpuls, kan opdage og ødelægge kræftceller in vivo ved at skabe små, skinnende dampbobler, der afslører cellerne og selektivt eksploderer dem.
Et papir i oktoberudgaven af tidsskriftet Biomaterialer beskriver virkningen af plasmonisk nanoboble -theranostik på zebrafisk implanteret med levende humane prostatacancerceller, demonstrere den guidede ablation af kræftceller i en levende organisme uden at beskadige værten.
Lapotko og hans kolleger udviklede begrebet celleteranostik til at forene tre vigtige behandlingsfaser - diagnose, terapi og bekræftelse af den terapeutiske handling - i én forbundet procedure. Den unikke afstemning af plasmoniske nanobubbler gør proceduren mulig. Deres dyremodel, zebrafisken, er næsten gennemsigtig, hvilket gør den ideel til sådan in vivo -forskning.
National Institutes of Health har erkendt potentialet i Lapotkos inspirerede teknik ved at finansiere yderligere forskning, der rummer et enormt potentiale for teranostik af kræft og andre sygdomme på mobilniveau. Lapotkos Plasmonic Nanobubble Lab, et fælles amerikansk-hviderussisk laboratorium for grundlæggende og biomedicinsk nanofotonik, har modtaget et tilskud til mere end $ 1 million i løbet af de næste fire år for at fortsætte udviklingen af teknikken.
I tidligere forskning i Lapotkos hjemmelaboratorium i National Academy of Sciences of Belarus, plasmoniske nanobobler demonstrerede deres theranostiske potentiale. I en anden undersøgelse af kardiovaskulære applikationer, nanobobler blev filmet og sprængte sig vej gennem arteriel plak. Jo stærkere laserpuls, desto mere skadelig er eksplosionen, når boblerne brister, gør teknikken yderst afstemmelig. Boblerne varierer i størrelse fra 50 nanometer til mere end 10 mikrometer.
I zebrafiskundersøgelsen, Lapotko og hans samarbejdspartnere hos Rice dirigerede antistofmærkede guldnanopartikler ind i de implanterede kræftceller. En kort laserpuls overophedede overfladen af nanopartiklerne og fordampede et meget tyndt volumen af det omgivende medium for at skabe små dampbobler, der ekspanderede og kollapsede inden for nanosekunder; dette efterlod cellerne ubeskadigede, men genererede et stærkt optisk spredningssignal, der var lyst nok til at detektere en enkelt kræftcelle.
Et sekund, stærkere puls genererede større nanobubbler, der eksploderede (eller, som forskerne kaldte det, "mekanisk ableret") målcellen uden at beskadige omgivende væv i zebrafisken. Spredning af laserlyset med den anden "dræber" -boble bekræftede cellulær ødelæggelse.
At processen er mekanisk af natur er nøglen, Sagde Lapotko. Nanobubblerne undgår faldgruberne ved kemo- eller strålebehandling, der kan skade sundt væv såvel som tumorer.
"Det er ikke en partikel, der dræber kræftcellen, men en forbigående og kort begivenhed, "sagde han." Vi konverterer lysenergi til mekanisk energi. "
Det nye tilskud vil give Lapotko og hans samarbejdspartnere mulighed for at studere de biologiske virkninger af plasmoniske nanobobler og derefter kombinere deres funktioner i en enkelt sekvens, der ville tage et mikrosekund at opdage og ødelægge en kræftcelle og bekræfte resultaterne. "Ved at indstille deres størrelse dynamisk, vi vil indstille deres biologiske virkning fra ikke -invasiv sansning til lokaliseret intracellulær lægemiddeltilførsel til selektiv eliminering af specifikke celler, " han sagde.
"At være en stealth, on-demand sonde med indstillelig funktion, den plasmoniske nanobobble kan anvendes på alle områder af medicin, da nanobobemekanismen er universel og kan anvendes til påvisning og manipulation af specifikke molekyler, eller til præcis mikrokirurgi. "
Lapotkos medforfattere på Biomaterialer papir er Daniel Wagner, adjunkt i biokemi og cellebiologi; Mary "Cindy" Farach-Carson, associeret viceprovost for forskning og professor i biokemi og cellebiologi; Jason Hafner, lektor i fysik og astronomi og kemi; Nikki Delk, postdoktor forskningsassistent; og Ekaterina Lukianova-Hleb, forsker i Plasmonic Nanobubble Lab.
 Varme artikler
Varme artikler
-
 Inkorporerer ferromagnetisme og superledning i et enkelt lag af molekylært supergitterFigur (A) giver en skematisk illustration af ICCD-metoden (Interlayer-space confined chemical design) til syntese af tantaldisulfid (TaS) 2 ) molekylært supergitter med de superledende områder og fe
Inkorporerer ferromagnetisme og superledning i et enkelt lag af molekylært supergitterFigur (A) giver en skematisk illustration af ICCD-metoden (Interlayer-space confined chemical design) til syntese af tantaldisulfid (TaS) 2 ) molekylært supergitter med de superledende områder og fe -
 Nyt værktøj til celleforskning kan hjælpe med at opklare sygdomshemmelighederNing Fang, Wei Sun og Gufeng Wang, forskere ved det amerikanske energiministeriums Ames Laboratory, for nylig gjort fremskridt i forståelsen af rotationsbevægelse i levende celler, der kan hjælpe fo
Nyt værktøj til celleforskning kan hjælpe med at opklare sygdomshemmelighederNing Fang, Wei Sun og Gufeng Wang, forskere ved det amerikanske energiministeriums Ames Laboratory, for nylig gjort fremskridt i forståelsen af rotationsbevægelse i levende celler, der kan hjælpe fo -
 Forskere udvikler nanofiltreringsmembran til højeffektiv farvestof/saltseparationDiagram af den dobbelt ladede membran fremstillet via katekol-amin kemi overfladeteknik. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Engineering (IPE) ved d
Forskere udvikler nanofiltreringsmembran til højeffektiv farvestof/saltseparationDiagram af den dobbelt ladede membran fremstillet via katekol-amin kemi overfladeteknik. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Engineering (IPE) ved d -
 Kunstig intelligens til at udforske den biomolekylære verdenKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har udviklet AI-drevne nanosensorer, der lader forskere spore forskellige slags biologiske molekyler uden at forstyrre dem. Den lille
Kunstig intelligens til at udforske den biomolekylære verdenKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har udviklet AI-drevne nanosensorer, der lader forskere spore forskellige slags biologiske molekyler uden at forstyrre dem. Den lille
- Undersøgelse finder farlige kviksølvniveauer i Amazonas fisk
- Katalysatorfremskridt kan føre til økonomiske brændselsceller
- Simuleringer viser tusinder af søer i Himalaya -bjergene med risiko for oversvømmelse på grund af…
- Hubble viser, at voldsomme udstrømninger fra spædbarnsstjerner måske ikke stopper dem i at vokse
- Uheldig timing og ændringshastighed kan være nok til at tippe et klimasystem
- De Havilland DH-4


