En enklere måde at fremstille proteiner på kan føre til nye nanomedicinske midler
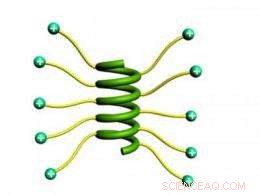
Forskere fandt ud af, at forlængede sidekæder med ladede ender gjorde det muligt for korte proteiner at sno sig sammen til en stabil helix. Kredit:Jianjun Cheng, University of Illinois
Forskere har udviklet en simpel metode til at lave korte proteinkæder med spiralstrukturer, der også kan opløses i vand, to ønskværdige egenskaber, der ikke ofte findes sammen. Sådanne strukturer kunne have anvendelser som byggesten til selvsamlende nanostrukturer og som midler til lægemiddel- og genlevering.
Anført af Jianjun Cheng, en professor i materialevidenskab og teknik ved University of Illinois, forskerholdet vil offentliggøre sine resultater i den 22. februar-udgave af tidsskriftet Naturkommunikation .
Materialeforskere har været interesseret i at designe store polymermolekyler, der kunne bruges som byggesten til selvsamlende strukturer. Udfordringen har været, at molekylerne generelt adopterer en kugleformet, sfærisk form, begrænse deres evne til at danne ordnede aggregater. Imidlertid, polypeptider - kæder af aminosyrer såsom proteiner - kan danne spiralformede strukturer. Korte polypeptidkæder, der antager en spiralform, fungerer som cylindriske stænger.
"Hvis du har to stive stænger, en positiv og en negativ, lige ved siden af hinanden, de kommer til at holde sig til hinanden. Hvis du har en måde at lægge ladningen på overfladen, kan de pakkes sammen i en tæt, kompakt måde, så de danner en tredimensionel struktur, " sagde Cheng.
Imidlertid, det er vanskeligt at fremstille spiralformede polypeptider, der er vandopløselige, så de kan anvendes i opløsning. Polypeptider opnår deres opløselighed fra sidekæder - molekylære strukturer, der stammer fra hvert aminosyreled i polypeptidkæden. Aminosyrer med positive eller negative ladninger i deres sidekæder er nødvendige for at få et polypeptid til at spredes i vand.
Problemet opstår, når kæder med ladede sidekæder danner spiralformede strukturer. Ladningerne forårsager en stærk frastødning mellem sidekæderne, hvilket destabiliserer den spiralformede konformation. Dette får vandopløselige polypeptider til at danne tilfældige spolestrukturer i stedet for de ønskede helixer.
Ved at udforske løsninger på gåden med spiralformet, vandopløselige polypeptider, forskere har prøvet flere komplicerede metoder. For eksempel, Forskere har forsøgt at pode meget vandopløselige kemikalier til sidekæderne for at øge polypeptidernes samlede opløselighed, eller skabe helixer med ladninger kun på den ene side.
"Du kan opnå den spiralformede struktur og opløseligheden, men du skal designe den spiralformede struktur på en meget speciel måde. Peptiddesignet har brug for en meget specifik sekvens. Så er du meget begrænset i den type polypeptid, du kan bygge, og det er ikke let at designe eller håndtere disse polypeptider, " sagde Cheng.
I modsætning, Chengs gruppe udviklede en meget ligetil løsning. Da den tætte nærhed af ladningerne forårsager den frastødning, der forstyrrer helixen, forskerne blot forlængede sidekæderne, flytte ladningerne længere fra rygraden og give dem mere frihed til at holde afstand til hinanden.
Forskerne observerede, at da de øgede længden af sidekæderne med ladninger i enden, polypeptidernes tilbøjelighed til at danne helixer steg også.
"Det er så simpel en idé – flyt ladningen væk fra rygraden, " sagde Cheng. "Det er slet ikke svært at lave de længere sidekæder, og det har fantastiske egenskaber til at afvikle spiralformede strukturer blot ved at skubbe afstanden mellem ladningen og rygraden."
Gruppen fandt ud af, at polypeptider med lange sidekæder ikke kun danner helixer, de udviser bemærkelsesværdig stabilitet, selv sammenlignet med ikke-ladede helixer. Helixerne virker immune over for temperatur, pH, og andre denaturerende midler, der ville afvikle de fleste polypeptider.
Dette kan forklare, hvorfor aminosyrer med store hydrofobe sidekæder ikke findes i naturen. En sådan uforanderlighed ville udelukke dynamisk vikling og afvikling af proteinstrukturer, som er afgørende for mange biologiske processer. Imidlertid, stiv stabilitet er et ønskeligt træk for de typer applikationer, som Chengs gruppe udforsker:nanostrukturer til lægemiddel- og genlevering, især rettet mod kræftsvulster og stamceller.
"Vi ønsker at teste sammenhængen mellem længderne af spiralerne og cirkulationen i kroppen for at se, hvad der er virkningen af formen og ladningen og sidekæderne for clearance i kroppen, "Cheng sagde. "Nylige undersøgelser viser, at aspektforholdet mellem nanostrukturerne - sfæriske strukturer versus rør - har en enorm indflydelse på deres penetration af tumorvæv og cirkulationshalveringstider i kroppen."
Cheng planlægger at skabe et bibliotek af korte spiralformede polypeptider med varierende rygradslængder, sidekædelængder og ladningstyper. Han håber at forenkle kemien yderligere og gøre materialerne bredt tilgængelige. Hans laboratorium har allerede vist, at spiralformede strukturer kan være effektive genleverings- og membrantransduktionsmidler, og opbygning af biblioteket af opløselige spiralformede molekyler vil muliggøre yderligere undersøgelse af skræddersyede sådanne nanostrukturer til specifikke biomedicinske anvendelser.
 Varme artikler
Varme artikler
-
 Ny teknik, der bruges til at studere grafeners reaktion på luftLokale overfladepotentialekort for syntetisk luft (venstre) og omgivende luft (højre), med den samme relative luftfugtighed på 40%. Scanningsstørrelsen er 6 × 3 mikrometer i kvadrat. Et internatio
Ny teknik, der bruges til at studere grafeners reaktion på luftLokale overfladepotentialekort for syntetisk luft (venstre) og omgivende luft (højre), med den samme relative luftfugtighed på 40%. Scanningsstørrelsen er 6 × 3 mikrometer i kvadrat. Et internatio -
 Banebrydende fund om nanopartikellevering af HIV/AIDS-medicin til hjernenKredit:CC0 Public Domain En biokemiforsker fra University of Miami Miller School of Medicine har fundet ud af, at et nanopartikel-lægemiddelleveringssystem kan reducere HIV/AIDS-virale reservoirer
Banebrydende fund om nanopartikellevering af HIV/AIDS-medicin til hjernenKredit:CC0 Public Domain En biokemiforsker fra University of Miami Miller School of Medicine har fundet ud af, at et nanopartikel-lægemiddelleveringssystem kan reducere HIV/AIDS-virale reservoirer -
 Grafensensor sporer kræftbiomarkørerEn illustration af en epitaksial grafenkanalsbiosensor til påvisning af målrettet 8-hydroxydeoxyguanosin (8-OHdG) biomarkør. (A) skematisk af MLEG -enhed (B) Tynd film af kovalent vedhæftede nitrofeny
Grafensensor sporer kræftbiomarkørerEn illustration af en epitaksial grafenkanalsbiosensor til påvisning af målrettet 8-hydroxydeoxyguanosin (8-OHdG) biomarkør. (A) skematisk af MLEG -enhed (B) Tynd film af kovalent vedhæftede nitrofeny -
 Grafenmikrofon overgår traditionel nikkel og tilbyder ultralyds rækkeviddeGenerisk mikrofon på lydbordet vises. Kredit:Pixabay 2015, CC0 Forskere har udviklet en grafenbaseret mikrofon, der er næsten 32 gange mere følsom end mikrofoner af standard nikkelbaseret konstruk
Grafenmikrofon overgår traditionel nikkel og tilbyder ultralyds rækkeviddeGenerisk mikrofon på lydbordet vises. Kredit:Pixabay 2015, CC0 Forskere har udviklet en grafenbaseret mikrofon, der er næsten 32 gange mere følsom end mikrofoner af standard nikkelbaseret konstruk
- Sådan beregnes den mekaniske fordel for et hjul og aksel
- Sådan beregnes teoretiske plader
- Nyt papir afslører, hvordan erfaringerne fra COVID-19 kunne forberede os på atomangreb
- Banebrydende blækopdagelse kan transformere produktionen af nye laser- og optoelektroniske enhede…
- Himmelske boondocks:Undersøgelser understøtter ideen om, at vi lever i et tomrum
- Sådan udføres titreringsberegninger


