Nanopartikler giver indsigt i interaktioner mellem enkeltstrenget DNA og deres bindingsproteiner
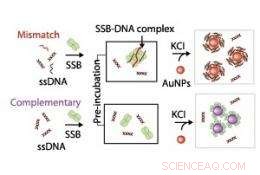
Skematisk illustration, der viser den mekanisme, der bruges til at probe interaktioner mellem enkeltstrenget DNA (ssDNA) og enkeltstrenget DNA-bindende protein (SSB). Kredit:2011 ACS
Dobbeltstrenget DNA skal skille sig ud i enkeltstrenge under replikation eller reparation for at tillade funktionelle molekyler at binde og udføre deres forskellige operationer. Cellulære proteiner binder specifikt til enkeltstrenget DNA for at forhindre deres for tidlige rekombination. Desværre, detaljerede undersøgelser af disse DNA-protein-interaktioner er blevet hindret af behovet for dyr instrumentering og tidskrævende mærkningsteknikker. Yen Nee Tan ved A*STAR Institute of Materials Research and Engineering og kolleger1 har nu udviklet en bekvem metode til at karakterisere interaktionerne mellem enkeltstrenget DNA og deres bindingsproteiner.
Forskerne brugte guldnanopartiklers optiske egenskaber til at undersøge mekanismen for protein-DNA-binding. Når nanopartiklerne var godt spredt i opløsning, de gav en lys rød farve, men når det er samlet, løsningen ændres til blå. Tan og kolleger opdagede, at når enkeltstrenget DNA og dets bindingsprotein begge var til stede i opløsningen, kombineret med et salt, der stimulerer aggregering af nanopartikler, DNA'et forblev rød i farven, hvilket indikerer, at DNA-proteinkomplekserne var bundet til nanopartiklerne gennem elektrosteriske stabiliseringskræfter. I modsætning, når proteinet eller enkeltstrenget DNA blev indført alene i saltopløsningen, der var et større skift til den blå-grå farve, indikerer nanopartikel-aggregering (se billede).
"Den største udfordring i dette arbejde var at bestemme de optimale betingelser for enkeltstrenget DNA til at binde med dets bindingsprotein for at danne komplekser, der giver den højeste stabilitet til guldnanopartikler fra salt-induceret aggregering, ” siger Tan.
Forskerne tilskriver binding af nanopartiklerne og DNA-proteinkomplekserne til tilstedeværelsen af svovlholdige grupper i proteinet, som er kendt for at skabe stærke bånd med guld. Proteinmolekylerne alene er mindre i molekylær størrelse end protein-DNA-komplekserne, fører til en mindre effektiv sterisk stabilisering af nanopartiklerne.
Tan og kolleger viste, at der var en minimumslængde af DNA-sekvensen, under hvilken den bindende protein-DNA-adhæsionsmekanisme kunne fungere. De fandt ud af, at bindingsproteinet havde en præference for binding til specifikke kemiske enheder (baser), som udgør DNA, og var i stand til at spotte DNA-sekvensvariationer, kaldet single nucleotide polymorphisms (SNP'er), selv i de yderste ender af molekylet, som er svære at identificere. Dobbeltstrenget DNA med SNP'er kan ikke binde sammen så tæt. Det bindende protein kan således binde sig til det dissocierede enkeltstrengede DNA for at danne protein-DNA-komplekser, tilbyder steder, hvor guldnanopartikler kan klæbe sig til.
"Vi planlægger at videreudvikle dette assay til et problemfrit genotypebestemmelsesassay for at påvise SNP'er i rigtige biologiske prøver indeholdende langt genomisk DNA, ” siger Tan.
 Varme artikler
Varme artikler
-
 Ny grafenbaseret antistoftest udviklet til påvisning af nyresygdomKredit:CC0 Public Domain Et tværfagligt team af forskere fra University of Manchester har udviklet et nyt grafen-baseret testsystem for sygdomsrelaterede antistoffer, oprindeligt rettet mod en nyr
Ny grafenbaseret antistoftest udviklet til påvisning af nyresygdomKredit:CC0 Public Domain Et tværfagligt team af forskere fra University of Manchester har udviklet et nyt grafen-baseret testsystem for sygdomsrelaterede antistoffer, oprindeligt rettet mod en nyr -
 Ingeniør krymper U-logoetDette elektronmikroskopbillede viser en forgyldt University of Utah -medaljon - et af flere officielle symboler og logoer for universitetet - der måler kun 70 mikron på tværs, som er cirka diameteren
Ingeniør krymper U-logoetDette elektronmikroskopbillede viser en forgyldt University of Utah -medaljon - et af flere officielle symboler og logoer for universitetet - der måler kun 70 mikron på tværs, som er cirka diameteren -
 Ikke-flygtig hukommelse baseret på ferroelektrisk-grafen felt-effekt transistorer er nu et skridt t…Skematisk illustration af et forbedret grafen-ferroelektrisk FET med SiO2-basallag. Kredit:2010 APS En grundlæggende komponent i en felteffekttransistor (FET) er portdelektrisk, som bestemmer anta
Ikke-flygtig hukommelse baseret på ferroelektrisk-grafen felt-effekt transistorer er nu et skridt t…Skematisk illustration af et forbedret grafen-ferroelektrisk FET med SiO2-basallag. Kredit:2010 APS En grundlæggende komponent i en felteffekttransistor (FET) er portdelektrisk, som bestemmer anta -
 Ingeniører udvikler det sorteste sorte materiale til datoMIT ingeniører har kogt et materiale lavet af kulstof nanorør, der er 10 gange sortere end noget, der tidligere er blevet rapporteret. Kredit:R. Capanna, A. Berlato, og A. Pinato Med undskyldninge
Ingeniører udvikler det sorteste sorte materiale til datoMIT ingeniører har kogt et materiale lavet af kulstof nanorør, der er 10 gange sortere end noget, der tidligere er blevet rapporteret. Kredit:R. Capanna, A. Berlato, og A. Pinato Med undskyldninge
- Superopløselig fotoakustisk mikroskopi finder tilstoppede blodkar
- NASA demonstrerer elektronik til længere Venus-overflademissioner
- Forskere undersøger den komplekse karakter af hjernerystelse
- Laserdrevet partikelaccelerator, der kan generere par elektronstråler med forskellige energier
- How to Cube Binomials
- Fangelys uden rygreflektioner


