Forbedrede nanopartikler leverer medicin ind i hjernen
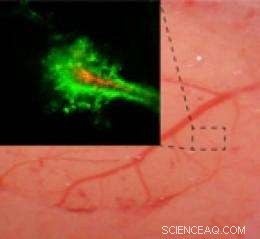
Realtidsbillede af en gnaverhjerne viser, at nanopartikler overtrukket med polyethylenglycol (PEG) (grøn) trænger længere ind i hjernen end partikler uden PEG-belægningen (rød). Kredit:Elizabeth Nance, Graeme Woodworth, Kurt Sømand
Hjernen er et notorisk svært organ at behandle, men Johns Hopkins-forskere rapporterer, at de er et skridt tættere på at have et system til levering af lægemidler, der er fleksibelt nok til at overvinde nogle centrale udfordringer, der skyldes hjernekræft og måske andre sygdomme, der påvirker det organ.
I en rapport, der blev offentliggjort online den 29. august i Videnskabelig translationel medicin , Johns Hopkins -teamet siger, at dets bioingeniører har designet nanopartikler, der sikkert og forudsigeligt kan infiltrere dybt ind i hjernen, når de testes i gnavere og humant væv.
"Vi er glade for at have fundet en måde at forhindre stofindlejrede partikler i at klæbe til deres omgivelser, så de kan sprede sig, når de er i hjernen, "siger Justin Hanes, Ph.d., Lewis J. Ort, professor i oftalmologi, med sekundære ansættelser inden for kemisk og biomolekylær teknik, biomedicinsk videnskab, onkologi, neurologisk kirurgi og miljø sundhedsvidenskab, og direktør for Johns Hopkins Center for Nanomedicine.
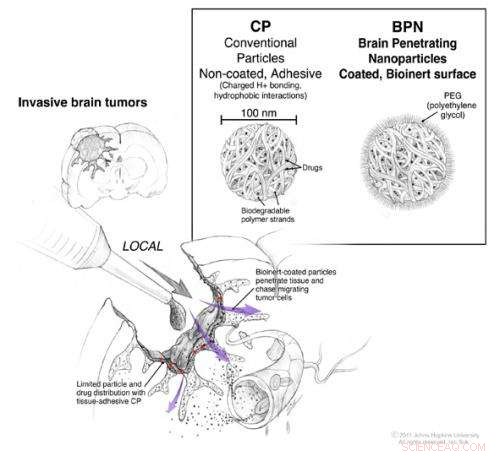
Under operationen for at afskære en hjernesvulst, direkte adgang til hjernen og rummet mellem dens celler er mulig. Konventionelle nanopartikler, der bærer kemoterapeutiske lægemidler, kan anvendes under operationen, men de forbliver i det væsentlige på overfladen, hvor de påføres (røde pile). Nanopartikler overtrukket med en tilstrækkelig mængde PEG har kapacitet til at diffundere gennem vævet (lilla pile), så de kan migrere mod de enkelte tumorceller, der er flygtet fra tumormassen. Kredit:© 2011. Johns Hopkins afdeling for neurokirurgi. Alle rettigheder forbeholdes. Ian Suk
Efter operation for at fjerne en hjernesvulst, standardbehandlingsprotokoller inkluderer anvendelse af kemoterapi direkte på det kirurgiske sted for at dræbe alle efterladte celler, der ikke kunne fjernes kirurgisk. Til dato, denne metode til at forhindre tumorgenfald er kun moderat vellykket, delvis, fordi det er svært at administrere en dosis kemoterapi, der er høj nok til at trænge ind i vævet tilstrækkeligt til at være effektivt og lavt nok til at være sikkert for patienten og sundt væv.
For at overvinde denne dosisudfordring, ingeniører designede nanopartikler-cirka en tusindedel af et menneskehårs diameter-der leverer stoffet i små, faste mængder over en periode. Konventionelle nanopartikler til levering af lægemidler fremstilles ved at indespærre lægemiddelmolekyler sammen med mikroskopiske, snorlignende molekyler i en stram kugle, som langsomt nedbrydes, når det kommer i kontakt med vand. Ifølge Charles Eberhart, M.D., en patolog fra Johns Hopkins og bidragsyder til dette arbejde, disse nanopartikler har historisk set ikke fungeret særlig godt, fordi de klæber til celler på applikationsstedet og har en tendens til ikke at vandre dybere ind i vævet.
Elizabeth Nance, en kandidatstuderende i kemisk og biomolekylær teknik på Hopkins, og Hopkins neurokirurg Graeme Woodworth, M.D., mistanke om, at lægemiddelindtrængning kan forbedres, hvis nanopartikler til levering af lægemidler interagerer minimalt med deres omgivelser. Nance først belagt nanostørrelse plastperler i forskellige størrelser med et klinisk testet molekyle kaldet PEG, eller poly (ethylenglycol), der havde vist andre at beskytte nanopartikler mod kroppens forsvarsmekanismer. Teamet begrundede, at et tæt lag PEG også kunne gøre perlerne mere glatte.
Holdet injicerede derefter de overtrukne perler i skiver af gnavere og humant hjernevæv. De mærkede først perlerne med glødende mærker, der gjorde det muligt for dem at se perlerne, da de bevægede sig gennem vævet. Sammenlignet med ikke-PEG-belagte perler, eller perler med en mindre tæt PEG -belægning, de fandt ud af, at en tæt belægning af PEG tillod større perler at trænge ind i vævet, selv de perler, der var næsten dobbelt så store som tidligere antaget at være det maksimalt mulige for penetration i hjernen. De testede derefter disse perler i levende gnaverhjerner og fandt de samme resultater.
Forskerne tog derefter bionedbrydelige nanopartikler med kemoterapimedicinet paclitaxel og overtrukte dem med PEG. Som forventet, i rottehjernevæv, nanopartikler uden PEG -belægningen bevægede sig meget lidt, mens PEG-dækkede nanopartikler fordelte sig ganske godt.
"Det er virkelig spændende, at vi nu har partikler, der kan bære fem gange mere stof, slippe den tre gange så lang tid og trænge længere ind i hjernen end før, "siger Nance." Det næste trin er at se, om vi kan bremse tumorvækst eller tilbagefald hos gnavere. "Woodworth tilføjede, at teamet" også ønsker at optimere partiklerne og parre dem med lægemidler til behandling af andre hjernesygdomme, som multipel sklerose, slag, traumatisk hjerneskade, Alzheimers og Parkinsons. "Et andet mål for teamet er at kunne administrere deres nanopartikler intravenøst, hvilket er forskning, de allerede er begyndt.
 Varme artikler
Varme artikler
-
 Forskere får et glimt af sollysets vej til elektricitetAndrew H. Marcus, venstre, og Mark C. Lonergan, begge fra University of Oregon, stand by UO spektroskopiudstyr, der var tilpasset til at studere fotoninteraktioner i fotoceller, der brugte blysulfid k
Forskere får et glimt af sollysets vej til elektricitetAndrew H. Marcus, venstre, og Mark C. Lonergan, begge fra University of Oregon, stand by UO spektroskopiudstyr, der var tilpasset til at studere fotoninteraktioner i fotoceller, der brugte blysulfid k -
 Naturinspireret design:Efterligner møløjne for at producere gennemsigtige anti-reflekterende belæ…Forskere har fundet en måde at producere gennemsigtige film med store områder, hvis nanostrukturer er inspireret af møløjestrukturen. Kredit:Ian Lindsay på Pixabay Der er mange menneskelige proble
Naturinspireret design:Efterligner møløjne for at producere gennemsigtige anti-reflekterende belæ…Forskere har fundet en måde at producere gennemsigtige film med store områder, hvis nanostrukturer er inspireret af møløjestrukturen. Kredit:Ian Lindsay på Pixabay Der er mange menneskelige proble -
 Nyt gennembrud for strukturel karakterisering af metalnanopartiklerKredit:hakkinen1 Forskere ved Xiamen University i Kina og University of Jyväskylä i Finland har karakteriseret en række stabile 1,5 nm metal nanoclusters indeholdende 44 metalatomer, stabiliseret
Nyt gennembrud for strukturel karakterisering af metalnanopartiklerKredit:hakkinen1 Forskere ved Xiamen University i Kina og University of Jyväskylä i Finland har karakteriseret en række stabile 1,5 nm metal nanoclusters indeholdende 44 metalatomer, stabiliseret -
 Ruter mod fejlfri grafenOptisk mikrofotografi af grafendomæner dannet på tværs af korngrænser. Kredit:Oxford University En ny måde at dyrke grafen på uden de defekter, der svækker det og forhindrer elektroner i at flyde
Ruter mod fejlfri grafenOptisk mikrofotografi af grafendomæner dannet på tværs af korngrænser. Kredit:Oxford University En ny måde at dyrke grafen på uden de defekter, der svækker det og forhindrer elektroner i at flyde
- Verdens korteste bølgelængde for en lodret hulrum overflade-emitterende laser demonstreret
- Sådan testes en Ford 9N-tændingscoil
- Forskning identificerer nøglesvaghed i moderne computersynsystemer
- Vintermonsuner blev stærkere under geomagnetisk vending
- Teoretisk undersøgelse viser, at stof har en tendens til at blive ordnet ved lave temperaturer
- Næsten hver femte af generation Y, der blev undersøgt, er kommet i gæld ved at bruge kontaktløse…


