Første i sin slags selvsamlede nanopartikler til målrettet og udløst termokemoterapi
(Phys.org) - Spændingen omkring potentialet for målrettede nanopartikler (NP'er), der kan kontrolleres af stimulering uden for kroppen til kræftbehandling, er vokset i løbet af de sidste par år. Mere specifikt, der har været stor opmærksomhed omkring nær-infrarødt (NIR) lys som en ideel metode til at stimulere nanopartikler udefra. NIR absorberes minimalt af hud og væv, har evnen til at trænge ind i dybt væv på en ikke -invasiv måde, og energien fra NIR -lys kan omdannes til varme af guldnanomaterialer til effektiv termisk ablation af sygt væv.
I ny forskning fra Brigham og Women's Hospital (BWH), forskere beskriver designet og effektiviteten af en første af sin art, selvsamlet, multifunktionel, NIR-responsive guld-nanoroder, der kan levere et kemoterapimedicin specifikt målrettet mod kræftceller og selektivt frigive lægemidlet som reaktion på en ekstern lysstråle, samtidig med at det skaber varme til synergistisk termokemo-medieret antitumoreffektivitet. Undersøgelsen offentliggøres elektronisk i Angewandte Chemie International Edition .
"Designet af denne guldnanorod og dens selvsamling var inspireret af naturen og muligheden for gratis DNA-strenge til at hybridisere på egen hånd uden at pålægge dem komplicerede kemiske processer, "forklarede Omid Farokhzad, MD, en anæstesilæge og direktør for laboratoriet for nanomedicin og biomaterialer ved BWH, og seniorforfatter af denne undersøgelse. "Hver funktionaliseret DNA -streng individuelt, og de selvmonterede komponenter som et system, spiller en tydelig, men integrerende rolle, hvilket resulterer i synergistisk målrettet og udløst termokemoterapi, der er i stand til at udrydde tumorer i vores prækliniske modeller. "
En DNA -streng er knyttet til guld -nanoroden, og den komplementære streng er knyttet til et stealth -lag og et homing -molekyle, der holder systemet under immunsystemets radar, mens det målrettes direkte mod kræftceller. Når DNA -strengene kommer sammen, den målrettede guld -nanorod dannes, og det dobbeltstrengede DNA fungerer som stillads til binding af kemoterapimedicinet, doxorubicin, som kan frigives som reaktion på NIR -lys, der samtidig resulterer i generering af varme af guldnanoroderne.
"Denne nye platform består af tre forskellige funktionelle komponenter og spiller hver en rolle i at bidrage til det tredobbelte slag af udløst termoterapi, kontrolleret frigivelse af doxorubicin, og målretning mod kræftceller, "forklarede Zeyu Xiao, Ph.d., en postdoktor ved BWH og hovedforfatter af denne undersøgelse.
For at demonstrere dette nanorodsystems robuste kapacitet, Farokhzad og kolleger brugte en præklinisk model til at evaluere in vivo antitumoreffektiviteten i to forskellige tumormodeller og fire forskellige grupper med forskellige lægemiddelregimenter, hver gruppe varierer i vægt og tumorstørrelse. Forskere administrerede en indsprøjtning af romanen, selvsamlet nanopartikel og derefter 10 minutter efter injektion, tumorerne blev bestrålet ved hjælp af NIR -lys, der aktiverede nanopartiklen ved hjælp af guldnanoroden og skabte varme. Resultaterne viste, at denne platform med succes leverede varme- og kræftbekæmpende lægemidler og synergistisk udryddede tumorer.
"Termisk ablation bruges allerede almindeligt i kræftbehandling, "sagde Dr. Farokhzad." Det, der er ekstremt spændende ved denne platform, er, at vi selektivt kan målrette kræftceller og derefter ramme tumoren to gange:først med en kontrolleret frigivelse af et kemoterapimedicin og derefter for det andet med udløst varmeinduktion fra aktivering af guldnanoroden. Og alt dette kan gøres ikke -invasivt. "
Forskere erkender, at der er behov for mere forskning i andre prækliniske modeller, før de tester sikkerheden og effekten af denne platform i kliniske forsøg på mennesker.
 Varme artikler
Varme artikler
-
 Billedværktøj kan hjælpe nanoelektronikken ved at screene små rørMetalliske og halvledende enkeltvægs carbon nanorør skelnes ved hjælp af et nyt billeddannelsesværktøj til hurtig screening af strukturerne. Teknologien kan fremskynde brugen af nanorør til at skabe
Billedværktøj kan hjælpe nanoelektronikken ved at screene små rørMetalliske og halvledende enkeltvægs carbon nanorør skelnes ved hjælp af et nyt billeddannelsesværktøj til hurtig screening af strukturerne. Teknologien kan fremskynde brugen af nanorør til at skabe -
 Direkte evolution bygger nanopartiklerIllustration af et DNA-indpakket enkeltvægget kulstof nanorør. Kredit:Benjamin Lambert, EPFL Nobelprisen i kemi 2018 gik til tre forskere, der udviklede metoden, der for altid ændrede proteintekni
Direkte evolution bygger nanopartiklerIllustration af et DNA-indpakket enkeltvægget kulstof nanorør. Kredit:Benjamin Lambert, EPFL Nobelprisen i kemi 2018 gik til tre forskere, der udviklede metoden, der for altid ændrede proteintekni -
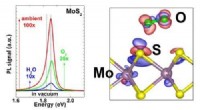 Forskere øger lysemissionen i 2D-halvledere med en faktor på 100(Venstre) Graf, der viser ændringen i fotoluminescens af MoS2 ved eksponering for H2O alene, O2 alene, og omgivende luft ved tryk på 7, 200, og 760 Torr, henholdsvis. (Højre) Figur, der viser ladnings
Forskere øger lysemissionen i 2D-halvledere med en faktor på 100(Venstre) Graf, der viser ændringen i fotoluminescens af MoS2 ved eksponering for H2O alene, O2 alene, og omgivende luft ved tryk på 7, 200, og 760 Torr, henholdsvis. (Højre) Figur, der viser ladnings -
 Grafen smarte membraner kan styre vandKredit:University of Manchester Forskere ved University of Manchesters National Graphene Institute (NGI) har opnået et længe søgt mål om elektrisk styring af vandstrømmen gennem membraner, som rap
Grafen smarte membraner kan styre vandKredit:University of Manchester Forskere ved University of Manchesters National Graphene Institute (NGI) har opnået et længe søgt mål om elektrisk styring af vandstrømmen gennem membraner, som rap
- Sjældent jernoxid kan kombineres med 2-D materialer til elektronisk, spintronic -enheder
- Den internationale rumstation passerer Venus og Saturn
- Nye ternære hydrider af lanthan og yttrium slutter sig til rækken af højtemperatur-superledere
- Hvad er den mest rigelige metal på jorden?
- Ny statistisk model forbedrer forudsigelseskraften af standardiserede testresultater
- Hvad Rocks Glow Under Black Light?


