Direkte evolution bygger nanopartikler

Illustration af et DNA-indpakket enkeltvægget kulstof nanorør. Kredit:Benjamin Lambert, EPFL
Nobelprisen i kemi 2018 gik til tre forskere, der udviklede metoden, der for altid ændrede proteinteknik:styret evolution. Efterligner naturlig evolution, rettet evolution styrer syntesen af proteiner med forbedrede eller nye funktioner.
Først, det originale protein muteres for at skabe en samling af mutante proteinvarianter. De proteinvarianter, der viser forbedrede eller mere ønskelige funktioner, udvælges. Disse udvalgte proteiner muteres derefter endnu en gang for at oprette en anden samling af proteinvarianter til endnu en udvælgelsesrunde. Denne cyklus gentages indtil en sidste, muteret protein udvikles med optimeret ydeevne sammenlignet med det originale protein.
Nu, forskere fra laboratoriet i Ardemis Boghossian ved EPFL, har været i stand til at bruge rettet evolution til at bygge ikke proteiner, men syntetiske nanopartikler. Disse nanopartikler bruges som optiske biosensorer - bittesmå enheder, der bruger lys til at detektere biologiske molekyler i luft, vand, eller blod. Optiske biosensorer er meget udbredt i biologisk forskning, udvikling af lægemidler, og medicinsk diagnostik, såsom overvågning i realtid af insulin og glukose hos diabetikere.
"Det smukke ved rettet evolution er, at vi kan konstruere et protein uden overhovedet at vide, hvordan dets struktur er relateret til dets funktion, " siger Boghossian. "Og vi har ikke engang denne information for de store, langt de fleste proteiner."
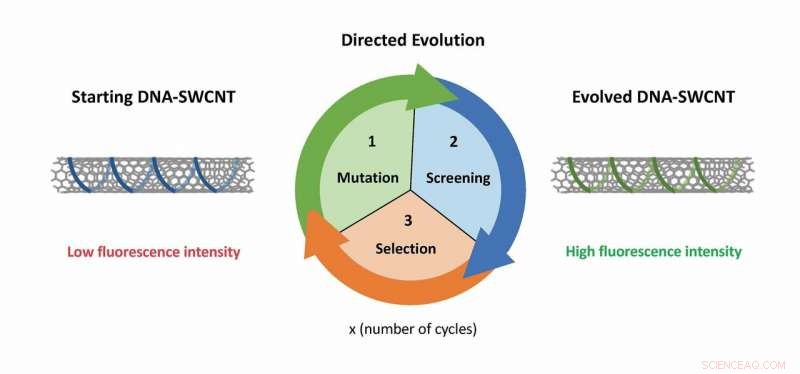
Generelt princip for den rettet udviklingstilgang anvendt på nanopartikel-DNA-SWCNT-komplekserne. Startkomplekset er et DNA-SWCNT med et svagt optisk signal. Dette udvikles gennem rettet evolution:(1) tilfældig mutation af DNA-sekvensen; (2) indpakning af SWCNT'erne med DNA'et og screening af kompleksets optiske signal; (3) udvælgelse af DNA-SWCNT-komplekserne, der udviser et forbedret optisk signal. Efter flere cyklusser af udvikling, vi kan udvikle DNA-SWCNT-komplekser, der viser forbedret optisk adfærd. Kredit:Benjamin Lambert (EPFL)
Hendes gruppe brugte rettet evolution til at modificere de optoelektroniske egenskaber af DNA-omviklede enkeltvæggede kulstofnanorør (eller, DNA-SWCNT'er, som de er forkortet), som er rør i nanostørrelse af kulstofatomer, der ligner sammenrullede plader af grafen dækket af DNA. Når de opdager deres mål, DNA-SWCNT'erne udsender et optisk signal, der kan trænge gennem komplekse biologiske væsker, som blod eller urin.
Ved at bruge en rettet udviklingstilgang, Boghossians team var i stand til at konstruere nye DNA-SWCNT'er med optiske signaler, der øges med op til 56% – og de gjorde det over kun to udviklingscyklusser.
"Størstedelen af forskere inden for dette felt screener bare store biblioteker af forskellige materialer i håb om at finde et med de egenskaber, de leder efter, " siger Boghossian. "I optiske nanosensorer, vi forsøger at forbedre egenskaber som selektivitet, lysstyrke, og følsomhed. Ved at anvende rettet evolution, vi giver forskere en guidet tilgang til at konstruere disse nanosensorer."
Undersøgelsen viser, at det, der i bund og grund er en bioingeniørteknik, kan bruges til mere rationelt at tune de optoelektroniske egenskaber af visse nanomaterialer. Boghossian forklarer:"Felter som materialevidenskab og fysik er for det meste optaget af at definere materielle struktur-funktionsforhold, gør materialer, der mangler denne information, vanskelige at konstruere. Men dette er et problem, naturen løste for milliarder af år siden - og i de seneste årtier, biologer har også taklet det. Jeg tror, vores undersøgelse viser, at som materialeforskere og fysikere, vi kan stadig lære et par pragmatiske lektioner fra biologer."
 Varme artikler
Varme artikler
-
 Små mikroorme kan implanteres under huden til kontinuerlig medicinsk overvågningEt scanningselektronmikroskopbillede viser et bundt af mikroorme produceret ved hjælp af en dampaflejringsproces udviklet af forskere ved MIT og Northeastern. Kredit:Gleason Lab Forskere ved MIT o
Små mikroorme kan implanteres under huden til kontinuerlig medicinsk overvågningEt scanningselektronmikroskopbillede viser et bundt af mikroorme produceret ved hjælp af en dampaflejringsproces udviklet af forskere ved MIT og Northeastern. Kredit:Gleason Lab Forskere ved MIT o -
 Skæring af grafenkagen(Phys.org) - Forskere ved University of Manchester har vist, at grafen kan bruges som en byggesten til at skabe nye 3D-krystalstrukturer, som ikke er begrænset af, hvad naturen kan producere. Sammenl
Skæring af grafenkagen(Phys.org) - Forskere ved University of Manchester har vist, at grafen kan bruges som en byggesten til at skabe nye 3D-krystalstrukturer, som ikke er begrænset af, hvad naturen kan producere. Sammenl -
 Grafen får en fætter i form af germanenDette er et 16,2 nm × 16,2 nm STM-billede af den modulerede honeycomb √7×√7 overbygning. Atomstrukturer (side- og topvisninger) og simulerede STM-billeder af tre forskellige modeller af germanen på √7
Grafen får en fætter i form af germanenDette er et 16,2 nm × 16,2 nm STM-billede af den modulerede honeycomb √7×√7 overbygning. Atomstrukturer (side- og topvisninger) og simulerede STM-billeder af tre forskellige modeller af germanen på √7 -
 Forskere skaber grafenbarriere for præcist at kontrollere molekyler til fremstilling af nanoelektro…Gengivelse af en grafenbarriere UCLA. Kredit:California NanoSystems Institute Gartnere bruger ofte plastikplader med strategisk placerede huller for at lade deres planter vokse, men forhindre ukru
Forskere skaber grafenbarriere for præcist at kontrollere molekyler til fremstilling af nanoelektro…Gengivelse af en grafenbarriere UCLA. Kredit:California NanoSystems Institute Gartnere bruger ofte plastikplader med strategisk placerede huller for at lade deres planter vokse, men forhindre ukru
- Verdensomspændende beviser på sammenhængen mellem uligheder i uddannelse og kognitiv funktion hos…
- Udbredt kulturel spredning af viden startede for 400 tusind år siden
- Hvor finder fotosyntese sted?
- Dyrereproduktion og -udvikling
- Hvordan man fortæller en Clam
- Hubble ser marsmånen kredser om den røde planet


