Foldetragte nøgle til biomimik

Denne AFM-mikrografik af 2-D S-lag samlet på glimmer viser to forskellige veje til krystallisering, den ene, hvor domanserne er 2-3 nanometer højere (hvide stiplede cirkler) end den anden. Forskelle i de to højdeprofiler, som blev målt langs de vandrette stiplede sorte linjer, var resultatet af kinetisk fangst. Kredit:Molecular Foundry
(Phys.org) —Proteiner er i stand til selv at samle sig til en lang række stærkt ordnede strukturer, der har en bred vifte af egenskaber. Gennem biomimik - teknologisk innovation inspireret af naturen - håber mennesker at efterligne proteiner og producere vores egen version af selvsamlende molekyler. En nøgle til at opnå dette er at forstå, hvordan proteinfoldning-en proces, der er kritisk for et proteins form og funktion-udvides fra individuelle proteiner til komplekse samlinger.
Forskere fra US Department of Energy (DOE) s Lawrence Berkeley National Laboratory (Berkeley Lab) har nu vist, at et koncept, der er bredt accepteret som beskriver foldning af et enkelt individuelt protein, også kan anvendes til selvsamling af flere proteiner. Deres resultater giver vigtige retningslinjer for fremtidig biomimikri indsats, især til fremstilling af enheder og syntese af nanoskala.
"Vi har gjort de første direkte observationer af, at konceptet med en foldetragt med kinetiske energifælder for individuelle proteiner lige kan anvendes på samling af bestilte proteinstrukturer, "siger Jim DeYoreo, en forsker med Molecular Foundry, et DOE -nanovidenskabscenter på Berkeley Lab, der ledede denne forskning sammen med Berkeley Lab -kemikeren Carolyn Bertozzi. "Vores resultater fortæller os, at bestræbelser på at opdage og kodificere designreglerne for selvsamling af komplekse molekylære systemer bliver nødt til at tage hensyn til virkningen af kinetiske fælder forbundet med konformationelle transformationer."
DeYoreo og Bertozzi er de tilsvarende forfattere til et papir udgivet af Procedurer fra National Academy of Sciences (PNAS), der rapporterede denne forskning. Papiret har titlen "Direkte observation af kinetiske fælder forbundet med strukturelle transformationer, der fører til flere veje for S-lags samling." Medforfatter af papiret var Seong-Ho Shin, Sungwook Chung, Babak Sanii og Luis Comolli.
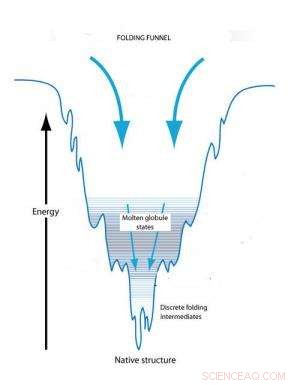
Foldetragt -konceptet forklarer proteinfoldning på grundlag af konformationsændringer for at nå en tilstand af minimal fri energi. Et udfoldet protein starter i en tilstand af høj fri og når sin oprindelige tilstand med minimal energi. Kinetiske fælder undervejs kan skabe forbigående smeltede kugler og foldende mellemprodukter.
Proteiner er i det væsentlige biomolekylære nanomaskiner, der er i stand til at udføre mange opgaver på grund af deres evne til at folde sig selv til en lang række former og former. Når individuelle proteiner samler sig i ordnede strukturer, vedtager det resulterende ensemble ofte konformationer, der er ganske forskellige fra de enkelte komponenters.
"For eksempel, kollagenmatricer, som udgør de organiske stilladser af knogler og tænder, er konstrueret af triple helices af individuelle kollagenmonomerer, "DeYoreo siger." Disse spiraler vil yderligere samle sig til meget organiserede snoede fibriller, der udviser en pseudohexagonal symmetri. "
Foldetragt -konceptet forklarer individuel proteinfoldning på grundlag af konformationsændringer for at nå en tilstand med minimal fri energi. Et udfoldet protein starter i en tilstand med høj fri energi, der gør dets opbygning ustabil. I første omgang, der er en række mulige tredimensionelle konformationer, der ville reducere denne frie energi. Imidlertid, når proteinet begynder at folde, den frie energi begynder at falde, og antallet af mulige konformationer begynder at falde ligesom den krympende bredde af en tragt. Bunden af tragten nås, når fri energi minimeres, og der kun er en tilgængelig konformation. Når den frie energi falder, imidlertid, der kan være kinetiske fælder undervejs, der kan stoppe foldningsprocessen og holde proteinet i delvist foldede konformationer, kendt som smeltede kugler og foldemellemprodukter, i længere tid. Til sidst vil disse fangede konformationstilstande blive transformeret til en stabil konformation, men formen og formen for den endelige konformation påvirkes af de kinetiske fælder.
"I en proteinfoldningstragt, tragtens vægge formodes ikke at være glatte, og de resulterende stød og dale definerer kinetiske fælder, "DeYoreo siger." Dette fysiske billede af foldning er blevet undersøgt i detaljer i enkeltmolekylniveau, men er ikke blevet overvejet til selvsamling af proteiner til udvidede arkitekturer, selvom konformationstransformationer er en del af selvmonteringsprocessen. "
DeYoreo, Bertozzi og deres kolleger tog skridt til at rette op på dette vidensunderskud ved at studere overfladelag (S-lag) proteiner, der selv samler sig til en krystallinsk membran omkring de enkelte celler af bakterier og Archaea. Denne ydre membran fungerer som det første kontaktpunkt mellem mikroben og dens miljø og er nøglen til mikrobens evne til at overleve. Ved hjælp af in situ Atomic Force Microscopy (AFM), forskerne afbildede i realtid og på molekylært niveau kinetisk indfangning under 2D selvsamling af S-lag proteinstrukturer på glimmeroverflader.
"Vi observerede, at selvsamling af S-lagsproteiner sporer langs to forskellige veje, en, der fører direkte til lavenergifinalen, bestilt stat, og den anden fører til en kinetisk fælde optaget af en langvarig forbigående tilstand, der er mere uorden, "DeYoreo siger." Selvom begge stater er let tilgængelige under krystalkernen, hvis systemet falder i højenergitilstand, flygte til finalen, lavenergitilstand er stærkt forhindret ved stuetemperatur. Dette demonstrerer betydningen af kinetiske fælder ved bestemmelse af vejen til S-lag krystallisering og tyder på, at konceptet med folde tragte er lige så gyldigt for selvsamling af udvidede proteinstrukturer. "
Sidste artikelMini-lab af grafen
Næste artikelForskere skaber nye mikropartikler, der selv samler sig som atomer til molekyler
 Varme artikler
Varme artikler
-
 Revolutionerende medicinsk bandage bruger nano-teknologi til at bekæmpe infektionForbindingen vil blive belagt med nanokapsler, der indeholder antibiotika og et farvestof (vist med rødt), der brydes op af toksiner (grønne) produceret af sygdomsfremkaldende bakterier (gul) (Phy
Revolutionerende medicinsk bandage bruger nano-teknologi til at bekæmpe infektionForbindingen vil blive belagt med nanokapsler, der indeholder antibiotika og et farvestof (vist med rødt), der brydes op af toksiner (grønne) produceret af sygdomsfremkaldende bakterier (gul) (Phy -
 Velcro-metode til mere præcis binding af lægemiddelpartiklerTU/e-forskere beviser selektivitet baseret på antallet af receptorer på cellevæggene. Kredit:TU Eindhoven For at levere lægemiddelpartikler til det rigtige sted i kroppen - et felt kendt som nanom
Velcro-metode til mere præcis binding af lægemiddelpartiklerTU/e-forskere beviser selektivitet baseret på antallet af receptorer på cellevæggene. Kredit:TU Eindhoven For at levere lægemiddelpartikler til det rigtige sted i kroppen - et felt kendt som nanom -
 Leder du efter kritisk adfærd i grafenGrafenark. Billedkredit:Lawrence Berkeley National Laboratory (PhysOrg.com) - Et af de håb, folk har for grafen, er i elektroniske enheder. Det ses som en mulig erstatning for silicium, på grund a
Leder du efter kritisk adfærd i grafenGrafenark. Billedkredit:Lawrence Berkeley National Laboratory (PhysOrg.com) - Et af de håb, folk har for grafen, er i elektroniske enheder. Det ses som en mulig erstatning for silicium, på grund a -
 Hvordan man skaber nanotråde kun tre atomer brede med en elektronstråleDette er en molekylær model, der viser strukturen af de nanotråde, der er skabt ud af et monolag af overgangsmetal-dichalcogenider (TMDCer). Kredit:Junhao Lin, Vanderbilt Universitet (Phys.org)
Hvordan man skaber nanotråde kun tre atomer brede med en elektronstråleDette er en molekylær model, der viser strukturen af de nanotråde, der er skabt ud af et monolag af overgangsmetal-dichalcogenider (TMDCer). Kredit:Junhao Lin, Vanderbilt Universitet (Phys.org)
- Nanopartikler til at dræbe kræftceller med varme
- Bitcoin-børspræsidentens død sætter millioner uden for rækkevidde
- Hvor uigennemtrængeligt er den uigennemtrængelige grafen?
- Papir:Resultaterne varierer for arbejdere, der advokater i ansættelsesvoldgiftstvister
- Hvordan en enkelt katalysator kan begynde at omdanne kuldioxid til brændstof på to måder
- Lizards, der bor i Tennessee


