Ny teknik omdanner effektivt antistoffer til stærkt afstemte nanostoffer
Kortlægning af nanobody bindende epitoper på GFP ved NMR. Kredit:(c) Naturmetoder , DOI:10,1038/nmeth.3170
Antistoffer, ansvarlig for genkendelse og homing på molekylære mål, er blandt de mest nyttige værktøjer inden for biologi og medicin. Nanobodies - antistoffers små fætre - kan udføre de samme opgaver, for eksempel markering af molekyler til forskning eller flagning af syge celler til destruktion. Men, takket være deres komparative enkelhed giver nanobodies den spændende udsigt til at være meget lettere at producere.
Desværre, deres løfte er ikke fuldt ud opfyldt, fordi forskere har manglet en effektiv måde at identificere nanobodyerne, der er tættest på deres mål. Imidlertid, et nyt system, udviklet af forskere ved Rockefeller University og deres samarbejdspartnere og beskrevet i dag i Naturmetoder , lover at gøre nanobodies dramatisk mere tilgængelige for alle former for forskning.
Antistoffer er defensive proteiner indsat af immunsystemet til at identificere og neutralisere angribere. Men deres magt kan også udnyttes på andre måder, og de bruges i biologi og medicin til visualisering af cellulære processer, angriber syge celler og leverer specifikke molekyler til bestemte steder. Ligesom deres større fætre, nanobodies kan også bruges til disse opgaver, men deres lille størrelse gør nanobodies meget lettere at dyrke på bakteriefabrikker. De kan også få adgang til svært tilgængelige steder, der kan være uden for grænser for større molekyler.
"Nanobodies har et enormt potentiale som alsidige og tilgængelige alternativer til konventionelle antistoffer, men desværre udgør de nuværende teknikker en flaskehals for at imødekomme efterspørgslen efter dem, "siger studieforfatter Michael Rout, leder af laboratoriet for cellulær og strukturel biologi hos Rockefeller. "Vi håber, at vores system vil gøre nanobodies med høj affinitet mere tilgængelige, og åbne op for mange nye mulige anvendelser for dem. "
I deres første undersøgelser, teamet genererede antistoffer med høj affinitet, dem, der er i stand til mest præcist at binde sig til deres mål, rettet mod to fluorescerende proteiner, som biologer ofte bruger som markører til at visualisere aktivitet i celler:GFP og mCherry. Deres nye system, ligesom eksisterende til dannelse af antistoffer, begynder med et dyr, i dette tilfælde lamaer placeret i et anlæg i Connecticut.
Lamaer blev valgt, fordi de antistofvarianter, de producerer, let kan ændres til at generere nanobistoffer, som kun er en tiendedel af vægten af et almindeligt antistof. Lamadyrene blev immuniseret med GFP og mCherry, får deres immunsystem til at danne antistoffer mod disse fremmede proteiner.
"Nøglen var at finde ud af en relativt hurtig måde at bestemme de genetiske sekvenser af antistofferne, der binder til målene med den største affinitet. Indtil nu har opnåelse af disse sekvenser med høj affinitet været noget af en hellig gral, "siger Brian Chait, Camille og Henry Dreyfus professor og leder af laboratoriet for massespektrometri og gasformig ionkemi ved Rockefeller. "Når disse sekvenser er opnået, det er let at konstruere bakterier til masseproduktion af antistofferne. "
Forskerne, ledet af kandidatstuderende Peter Fridy og postdoc Yinyin Li, startede med at lave antistofsekvensdatabaser fra RNA isoleret ud af antistofproducerende celler i lamaernes knoglemarv. Næste, de plukkede de strammeste bindende GFP- og mCherry -antistoffer ud fra blodprøver fra de samme lamaer, og skær dem kemisk i mindre stykker, beholder kun den antigenbindende sektion for at oprette nanostoffer.
De bestemte derefter delsekvenser af aminosyrerne, der udgjorde proteinet i nanoboderne med en teknik kendt som massespektrometri. Ved hjælp af en computeralgoritme kaldet "lama magi, "udviklet af David Fenyö og Sarah Keegan fra New York University School of Medicine, de matchede sammensætningen af de højeste affinitets -nanostoffer med den originale RNA -sekvens. Med denne sekvens, de kunne konstruere bakterier til at masseproducere nanobodies, før de blev taget i brug i forsøg.
Antistoffer bruges ofte til at isolere en bestemt struktur i en celle, så forskere kan fjerne og undersøge den, og teamet gjorde netop det med deres nye nanobodies. De rensede forskellige cellulære strukturer mærket med GFP eller mCherry, og visualiserede også disse strukturer in situ.
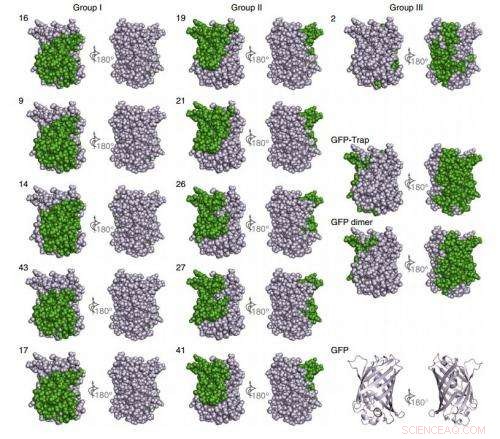
Alt i alt, deres procedure genererede 25 typer nanobistoffer, der er i stand til præcist at målrette mod GFP og seks til mCherry, et langt mere mangfoldigt sæt nanobistoffer med høj affinitet, end det typisk er muligt med konventionelle teknikker.
Denne overflod åbner for nye muligheder. Forskere kan kun vælge de bedste, eliminering af nanoboder, der tilfældigt krydsreagerer med andre molekyler, eller snor to nanobistoffer sammen, der fastgøres til forskellige pletter på det samme målmolekyle for at generere en dimer med superhøj affinitet, nøjagtigt som forskerne demonstrerede for GFP nanobodies. Denne superhøje affinitet kan være en stærk funktion ved levering af terapeutiske eller diagnostiske molekyler, fordi det ville sænke den nødvendige dosis, og så reducere uønskede bivirkninger.
"I betragtning af at vi nu let kan identificere suiter med nanobistoffer med høj affinitet, fremtiden for dem som forskningsværktøjer, diagnostik og terapi ser lyst ud, "siger Rout.
 Varme artikler
Varme artikler
-
 Gør kompositmateriale smart med ædelmetalFysiker Dikran Boyaciyan syntetiserer polymerbørster i laboratoriet. Kredit:Sebastian Keuth Doping af polymerbørster med guldnanopartikler resulterer i et omskifteligt kompositmateriale, som ændre
Gør kompositmateriale smart med ædelmetalFysiker Dikran Boyaciyan syntetiserer polymerbørster i laboratoriet. Kredit:Sebastian Keuth Doping af polymerbørster med guldnanopartikler resulterer i et omskifteligt kompositmateriale, som ændre -
 Intelligente nanomaterialer til fotonikPh.d.-studerende Quyet Ngo studerer optiske fibre funktionaliserede af 2D-materialer. Kredit:Jens Meyer/University of Jena Siden Nobelprisen i fysik blev tildelt for forskning i grafen i 2010, 2D-
Intelligente nanomaterialer til fotonikPh.d.-studerende Quyet Ngo studerer optiske fibre funktionaliserede af 2D-materialer. Kredit:Jens Meyer/University of Jena Siden Nobelprisen i fysik blev tildelt for forskning i grafen i 2010, 2D- -
 At stikke grafen resulterer i afskalning og selvsamling af båndSelvanimerede grafenark samles spontant til flerlagsbånd. Kredit:(c) Domhnall Malone (Phys.org) – Et par forskere fra Trinity College i Irland har fundet ud af, at grafenplader er i stand til spon
At stikke grafen resulterer i afskalning og selvsamling af båndSelvanimerede grafenark samles spontant til flerlagsbånd. Kredit:(c) Domhnall Malone (Phys.org) – Et par forskere fra Trinity College i Irland har fundet ud af, at grafenplader er i stand til spon -
 Grib vira ud af den blå luft:Den igangværende søgen efter at fremstille funktionelle biosensorerEt foreslået fremtidigt samfund. Kredit:Tohoku University Fremtiden kan rumme bærbare og bærbare sensorer til at detektere vira og bakterier i det omgivende miljø. Men vi er der ikke endnu. Forske
Grib vira ud af den blå luft:Den igangværende søgen efter at fremstille funktionelle biosensorerEt foreslået fremtidigt samfund. Kredit:Tohoku University Fremtiden kan rumme bærbare og bærbare sensorer til at detektere vira og bakterier i det omgivende miljø. Men vi er der ikke endnu. Forske
- Hvordan får folk kvælstof i deres organer?
- Forskere bruger elektronblæk til at skrive på grafenpapir
- Enheder kan reducere fibre produceret i vasketøjscyklus med op til 80%
- Sådan konverteres negative tal til binær
- Ny belægning kan hjælpe ledudskiftninger med at binde sig bedre med knogler
- Verdens ældste periodiske diagram fundet i St. Andrews


