Spændingstester til at slå hjerteceller

Forskere har haft held med at registrere det elektriske potentiale over membranen af kontraherende hjerteceller (symbol). Kredit:Keystone / Science Photo Library / Beermedia / Fotolia / Montage
For første gang, Det er lykkedes for forskere at registrere strømmen i membrankanalerne i sammentrækkende hjerteceller. At gøre dette, forskerne kombinerede et atomkraftmikroskop med en meget brugt metode til at måle elektriske signaler i celler.
Elektriske impulser spiller en vigtig rolle i celler i den menneskelige krop. For eksempel, neuroner bruger disse impulser til at overføre information langs deres grene, og kroppen bruger dem også til at kontrollere sammentrækningen af muskler. Impulserne genereres, når specielle kanalproteiner åbner sig i den ydre kappe af cellerne, lade ladede molekyler (ioner) komme ind i eller ud af cellen. Disse proteiner omtales som ionkanaler. Siden 1970'erne, en metode har været tilgængelig for forskere, der gør det muligt at måle aktiviteten af disse kanaler, men indtil nu er denne metode primært blevet brugt på celler, der ikke bevæger sig. Elektroingeniører ved ETH Zürich og biologer fra universitetet i Bern har nu udviklet metoden yderligere, så de nemt kan registrere aktiviteten af bevægelige celler, såsom at slå hjertemuskelceller i en vævskulturskål.
Den eksisterende metode involverer at placere en glaspipette mod den ydre membran af en celle. Åbningen i spidsen af pipetten er så lille, at den kun rører en brøkdel af celleoverfladen. Ideelt set denne lille del af cellemembranen har præcis én ionkanal. Indersiden af pipetten er fyldt med en ledende væske og en elektrode, som gør det muligt at måle forskelle i ladningen mellem den ydre del af cellen og cellens indre (dvs. et elektrisk potentiale) og midlertidige ændringer i dette potentiale som følge af aktivitet i ionkanalerne. Metoden omtales som patch-clamp-teknikken, fordi pipetten bruges til at klemme et plaster af cellemembranen.
Atomkraftmikroskop med mikroinjektionsnål
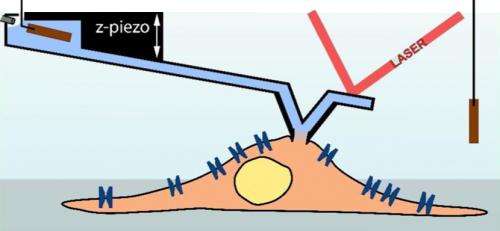
En atomkraftmikroskop-registreringsnål (lyseblå) tjener som en pipette for at måle en celle (lysebrun; skema). (Illustration:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society) En atomkraftmikroskop-registreringsnål (lyseblå) tjener som en pipette for at måle en celle (lysebrun; skema). Kredit:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society
Anført af Tomaso Zambelli, underviser ved Institute of Biomedical Engineering ved ETH Zürich, og Hugues Abriel, en professor ved Institut for Klinisk Forskning ved Universitetet i Bern, forskerne har nu kombineret denne teknik med et atomkraftmikroskop. En sensorspids er placeret på en bevægelig holder - en såkaldt cantilever - for at scanne overfladen af den mikroskopiske genstand. For flere år siden, det lykkedes forskerne at producere sensorspidser med en intern kanal, som tillader computerstyret injektion af molekyler i en celle. Denne teknik markedsføres nu af ETH-spin-off Cytosurge. Imidlertid, forskerne fortsatte udviklingen af denne teknik ved at forsyne mikroinjektionsnålen med en elektrode til at udføre patch-clamp-målinger. Forskerne har nu offentliggjort de vellykkede resultater af denne satsning i tidsskriftet Nano bogstaver .
Patch-clamp-teknikken er ikke kun en central metode til grundforskning i cellebiologi, det bruges også rutinemæssigt i udviklingen af nye lægemidler. For eksempel, medicinalindustrien er lovpligtig som en del af godkendelsesprocessen for nye lægemidler for at teste, om disse lægemidler interagerer med ionkanaler. Et lægemiddel, der blokerer ionkanaler, kan forårsage alvorlig hjerterytmeforstyrrelse hos patienter, som bør undgås for enhver pris.
Længere målinger og automatisering mulig
I tilfælde af den konventionelle patch-clamp-teknik, en operatør placerer manuelt pipetten mod cellen; selvom der findes automatiserede procedurer, deres applikationer er begrænsede. Dermed, cellerne, der testes, skal have samme størrelse og form og må ikke bevæge sig (som hjerteceller gør).
I tilfælde af den nye metode, mikronålen styres af en computer ved hjælp af kraftmålinger fra atomkraftmikroskopet til at holde den i konstant kort afstand fra celleoverfladen. "Dette gør kontakten mellem nålen og cellen meget mere stabil, som giver os mulighed for at tage målinger over længere tid og endda teste bevægelige celler, " forklarer Zambelli. For første gang, forskere er således lykkedes med at måle elektriske potentialeændringer i ionkanalerne i bankende hjerteceller. Zambelli siger, at han også kan forestille sig at bruge dette som grundlag for udvikling af en automatiseret metode til at teste enhver celle, uanset dens form eller størrelse.
 Varme artikler
Varme artikler
-
 Sporing af topologiske forhold i grafenScanningstunnelmikroskopets målinger blev foretaget i Solid Surfaces Analysis-laboratoriet ved Chemnitz University of Technology af forskere, herunder doktorand Thi Thuy Nhung Nguyen. Kredit:Pressekon
Sporing af topologiske forhold i grafenScanningstunnelmikroskopets målinger blev foretaget i Solid Surfaces Analysis-laboratoriet ved Chemnitz University of Technology af forskere, herunder doktorand Thi Thuy Nhung Nguyen. Kredit:Pressekon -
 Forbedret polymer og ny samlingsmetode til ultraformbare elektroniske tatoveringsenhederEn sandwich af trykte kredsløb og SBS-elastomer er kun 750 nm tyk, for ekstrem høj fleksibilitet og komfort. Kredit:Waseda University En gruppe forskere ved Waseda University har udviklet processe
Forbedret polymer og ny samlingsmetode til ultraformbare elektroniske tatoveringsenhederEn sandwich af trykte kredsløb og SBS-elastomer er kun 750 nm tyk, for ekstrem høj fleksibilitet og komfort. Kredit:Waseda University En gruppe forskere ved Waseda University har udviklet processe -
 Team avancerer GaN-on-Silicon til skalerbare transistorer med høj elektronmobilitetGaN på 200 mm Si wafer tykkelse kortlægningsbillede. Kredit:University of Illinois Et team af forskere ved University of Illinois i Urbana-Champaign har avanceret galliumnitrid (GaN)-på-silicium-t
Team avancerer GaN-on-Silicon til skalerbare transistorer med høj elektronmobilitetGaN på 200 mm Si wafer tykkelse kortlægningsbillede. Kredit:University of Illinois Et team af forskere ved University of Illinois i Urbana-Champaign har avanceret galliumnitrid (GaN)-på-silicium-t -
 Fleksibelt batteri, ikke nødvendigt med lithiumRice University postdoc-forsker Yang Yang har en energilagringsenhed med de bedste kvaliteter af batterier og superkondensatorer i en skalerbar, fleksibel pakke. Kredit:Jeff Fitlow (Phys.org) —Et
Fleksibelt batteri, ikke nødvendigt med lithiumRice University postdoc-forsker Yang Yang har en energilagringsenhed med de bedste kvaliteter af batterier og superkondensatorer i en skalerbar, fleksibel pakke. Kredit:Jeff Fitlow (Phys.org) —Et
- Fast track -kontrol fremskynder skift af kvantebits
- Brug af mikrokredit til at øge risudbyttet i Bangladesh
- Billede:Sentinel-2A over det vestlige Texas
- NASA -rumlasere kortlægger smeltevandssøer i Antarktis med slående præcision
- Største rekord for aromatisk ringstørrelse brudt med 162 π elektroner
- Sælgere på websteder med rubrikannoncer favoriserer købere fra velhavende kvarterer


