Forskning kan føre til nanosensorer, der genkender fibrinogen, insulin, eller andre biomarkører
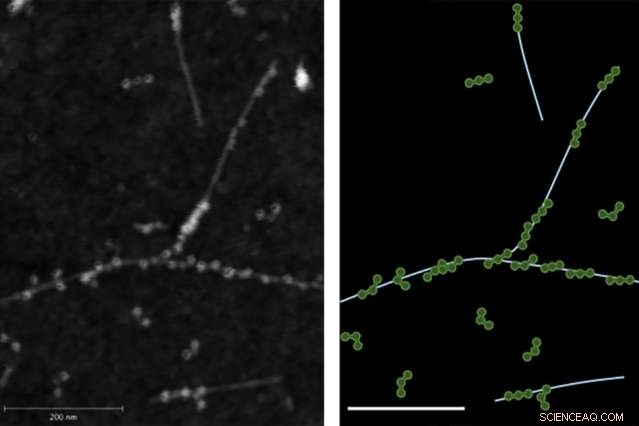
Atomic-force microscopy (AFM) billedet til venstre viser den fysiske binding mellem fibrinogenproteiner og enkeltvæggede kulstof nanorør. Til højre ses et spor af AFM-billedet med fibrinogen i grønt og nanorør i lyseblåt.
Brug af kulstof nanorør, MIT kemiingeniører har udtænkt en ny metode til at påvise proteiner, herunder fibrinogen, en af de koagulationsfaktorer, der er kritiske for blodkoagulationskaskaden.
Denne tilgang, hvis udviklet til en implanterbar sensor, kan være nyttig til overvågning af patienter, der tager blodfortyndende medicin, giver lægerne mulighed for at sikre sig, at stofferne ikke forstyrrer blodkoagulationen for meget.
Den nye metode er den første til at skabe syntetiske genkendelsessteder (svarende til naturlige antistoffer) for proteiner og til at koble dem direkte til en kraftig nanosensor såsom et kulstofnanorør. Forskerne har også gjort betydelige fremskridt med et lignende genkendelsessted for insulin, som kunne muliggøre bedre overvågning af patienter med diabetes. Det kan også være muligt at bruge denne tilgang til at opdage proteiner forbundet med kræft eller hjertesygdomme, siger Michael Strano, Carbon P. Dubbs professor i kemiteknik ved MIT.
Strano er seniorforfatter til et papir, der beskriver metoden i Nature Communications. Gili Bisker, en postdoc i Stranos laboratorium, er avisens hovedforfatter.
En målrettet søgning
Den nye sensor er det seneste eksempel på en metode udviklet i Stranos laboratorium, kendt som Corona Phase Molecular Recognition (CoPhMoRe).

Dette scanningselektronmikroskopbillede viser enkeltvæggede kulstofnanorør, det udgangsmateriale, som forskerne bruger.
Denne teknik drager fordel af interaktionerne mellem en given polymer og en nanopartikeloverflade, såsom overfladen af et fluorescerende enkeltvægget carbon nanorør, når polymeren vikles rundt om nanorøret.
Visse områder af polymererne låser sig fast på nanopartikeloverfladen som ankre, mens andre regioner strækker sig udad i deres miljø. Denne udadvendte region, også kendt som den adsorberede fase eller corona, har en 3-D struktur, der afhænger af polymerens sammensætning.
CoPhMoRe virker, når en specifik polymer adsorberer til nanopartikeloverfladen og skaber en korona, der genkender målmolekylet. Disse interaktioner er meget specifikke, ligesom bindingen mellem et antistof og dets mål. Binding af målet ændrer kulstofnanorørets naturlige fluorescens, giver forskerne mulighed for at måle, hvor meget af målmolekylet der er til stede.
Stranos laboratorium har tidligere brugt denne tilgang til at finde genkendelsessteder og udvikle nansensorer for østradiol og riboflavin, blandt andre molekyler. Det nye papir repræsenterer deres første forsøg på at identificere koronafaser, der kan detektere proteiner, som er større, mere komplekst, og mere skrøbelige end molekylerne identificeret af deres tidligere sensorer.
Til denne undersøgelse, Bisker begyndte med at screene kulstof nanorør pakket ind i 20 forskellige polymerer, herunder DNA, RNA, og polyethylenglycol (PEG), en polymer, der ofte tilsættes lægemidler for at øge deres levetid i blodbanen.
På egen hånd, ingen af polymererne havde nogen affinitet for de 14 testede proteiner, alt taget fra menneskeblod. Imidlertid, da forskerne testede polymer-omviklede nanorør mod de samme proteiner, de viste et match mellem et af de modificerede nanorør og fibrinogen.
"En kemiker eller en biolog ville ikke på forhånd være i stand til at forudsige, at der skulle være nogen form for affinitet mellem fibrinogen og denne coronafase, " siger Strano. "Det er virkelig en ny form for molekylær genkendelse."
Fibrinogen, et af de mest udbredte proteiner i menneskeligt blod, er en del af blodkoagulationskaskaden. Når et blodkar er beskadiget, et enzym kaldet thrombin omdanner fibrinogen til fibrin, et trævlet protein, der danner blodpropper for at forsegle såret.
En sensor for fibrinogen kan hjælpe læger med at afgøre, om patienter, der tager blodfortyndende medicin, stadig har tilstrækkelig koagulationsevne til at beskytte dem mod skader. og kunne give lægerne mulighed for at beregne mere finjusterede doser. Det kan også bruges til at teste patienters blodpropper, før de skal opereres, eller for at overvåge sårheling, siger Bisker.
Syntetiske antistoffer
Forskerne mener, at deres syntetiske molekylære genkendelsesmidler er en forbedring i forhold til eksisterende naturlige systemer baseret på antistoffer eller DNA-sekvenser kendt som aptamerer, som er mere skrøbelige og har tendens til at nedbrydes over tid.
"En af fordelene ved dette er, at det er et fuldstændig syntetisk system, der kan have en meget længere levetid i kroppen, siger Bisker.
I 2013 forskere i Stranos laboratorium demonstrerede, at kulstof nanorør-sensorer kan forblive aktive i mus i mere end et år efter at være blevet indlejret i en polymergel og kirurgisk implanteret under huden.
Ud over insulin, forskerne er også interesserede i at påvise troponin, et protein, der frigives af døende hjerteceller, eller påvisning af proteiner forbundet med kræft, hvilket ville være nyttigt til at overvåge succesen af kemoterapi. Disse og andre proteinsensorer kan blive kritiske komponenter i enheder, der afgiver lægemidler som reaktion på et tegn på sygdom.
"Ved at måle terapeutiske markører i den menneskelige krop i realtid, vi kan aktivere lægemiddelleveringssystemer, der er meget smartere, og frigiver lægemidler i præcise mængder, " siger Strano. "Men måling af disse biomarkører er det første skridt."
Sidste artikelNanoenhed, bygge dig selv
Næste artikelNano-skaller leverer molekyler, der fortæller knoglerne at reparere sig selv
 Varme artikler
Varme artikler
-
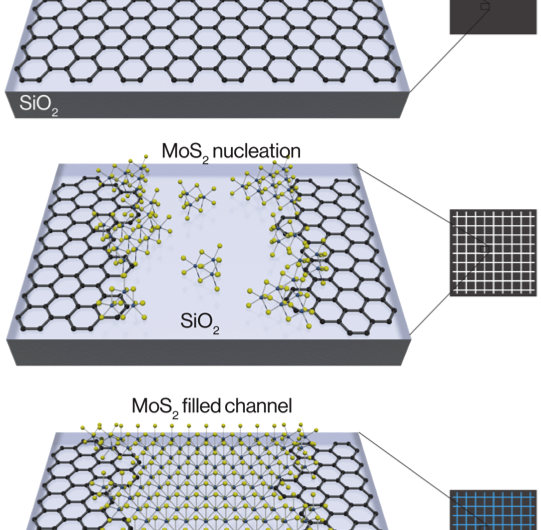 Forskere dyrker atomisk tynde transistorer og kredsløbDette skema viser den kemiske samling af todimensionelle krystaller. Grafen ætses først ind i kanaler, og TMDC-molybdændisulfidet (MoS2) begynder at danne kerne omkring kanterne og inde i kanalen. På
Forskere dyrker atomisk tynde transistorer og kredsløbDette skema viser den kemiske samling af todimensionelle krystaller. Grafen ætses først ind i kanaler, og TMDC-molybdændisulfidet (MoS2) begynder at danne kerne omkring kanterne og inde i kanalen. På -
 Farvekodningssensor:Nanostrukturer til kontaktløs kontrolDisse billeder viser, hvordan den fotoniske sensor omsætter fingerbevægelser til farveændringer, som den fotoniske krystal reagerer på ændringen i lokal luftfugtighed forårsaget af tilgangen af fing
Farvekodningssensor:Nanostrukturer til kontaktløs kontrolDisse billeder viser, hvordan den fotoniske sensor omsætter fingerbevægelser til farveændringer, som den fotoniske krystal reagerer på ændringen i lokal luftfugtighed forårsaget af tilgangen af fing -
 Guld nanocluster arrays vil forbedre SERS sensorer, siger forskereSkematisk af nanocluster SERS-substratet i plane chip og fiberoptiske konfigurationer. Kuppelformen af guld nanoclusterne afspejler formen af de halvkugleformede polymer nanostrukturer på den unde
Guld nanocluster arrays vil forbedre SERS sensorer, siger forskereSkematisk af nanocluster SERS-substratet i plane chip og fiberoptiske konfigurationer. Kuppelformen af guld nanoclusterne afspejler formen af de halvkugleformede polymer nanostrukturer på den unde -
 Elektronhop i grafenoxid fører til meget følsom sansningUnder UV-belysning, fotogenererede elektroner fra titandioxidet fanges af grafenoxidet. Elektronerne hopper til den anden side af grafenoxidet og kan reducere sølvioner, resulterer i vækst af sølv nan
Elektronhop i grafenoxid fører til meget følsom sansningUnder UV-belysning, fotogenererede elektroner fra titandioxidet fanges af grafenoxidet. Elektronerne hopper til den anden side af grafenoxidet og kan reducere sølvioner, resulterer i vækst af sølv nan
- Global styring skal overvinde en tidsånd af mistillid for at tackle verdens miljøproblemer
- Serendipity afdækker borophenes potentiale
- Sådan bruges en binomial tabel
- Billede:Australias sydvestlige hjørne
- Ikke-tobaksplante identificeret i gammel pibe for første gang
- Tyskland indrømmer, at det vil ligge langt under klimamålet for 2020


