Foreslået kvante-nano-MRI kunne generere billeder med opløsning på angstrom-niveau
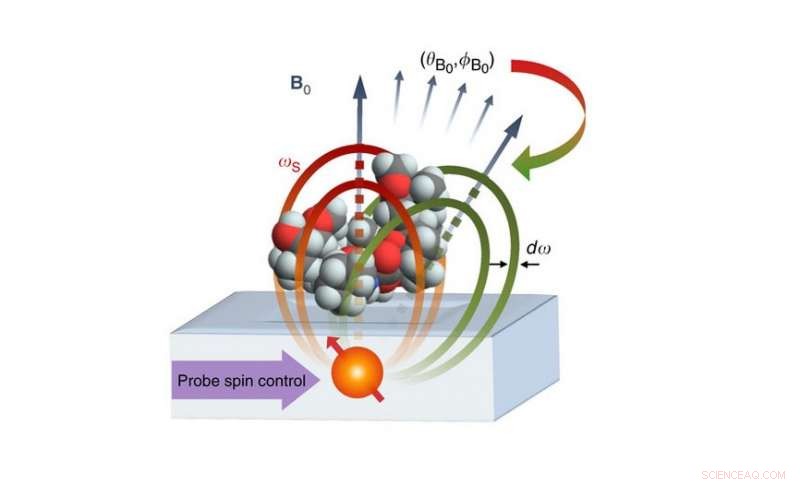
Den foreslåede nano-MRI-opsætning består af en atomær qubit placeret 2-4 nm under en overflade, der indeholder et molekyle. Qubit'en fungerer som både sensor og kilde til magnetfeltet til kodning af molekylets nukleare spins. Kernedensitetsdataene bruges derefter til at generere et 3D-billede af den molekylære struktur med opløsning på ångstrom-niveau. Kredit:Perunicic et al., Naturkommunikation
(Phys.org) – Svarende til den måde, en konventionel magnetisk resonansbilleddannelse (MRI)-maskine bruger store magneter til at generere 3D-billeder, fysikere har udviklet et forslag til en kvante-nano-MRI-maskine, der ville bruge de magnetiske egenskaber af en enkelt atomær qubit til at generere 3D-billeder med ångstrøm-niveau (0,1 nanometer) opløsning. Den nye teknik kan føre til udviklingen af enkelt-molekyle mikroskoper til billeddannelse af biomolekyler, med anvendelser inden for lægemiddelopdagelse og bedre forståelse af sygdomme.
Forskerne, ledet af Lloyd Hollenberg, en fysikprofessor ved University of Melbourne, har udgivet et papir om den nye teknik i et nyligt nummer af Naturkommunikation .
"Kontinuerlige videnskabelige fremskridt gennem de sidste årtier har gjort os i stand til at forstå og derfor helbrede mange medicinske problemer i makroskopisk skala, for eksempel knoglebrud eller blodpropper, " fortalte hovedforfatter Viktor Perunicic ved University of Melbourne Phys.org . "Imidlertid, de sygdomme, som menneskeheden står over for i dag, er mikroskopiske, da de stammer fra funktionsfejl på molekylært niveau, for eksempel et protein med en deformeret form et sted i en celle. Kræft, diabetes, virusinfektioner og mange andre har dette til fælles, men på nuværende tidspunkt er der næsten ingen måde at se, hvad der sker inde i vores kroppe på dette niveau.
"I vores arbejde vi sigter mod at løse dette problem ved at udvikle en plan for teknologi, der kan muliggøre direkte 3D visuel indsigt i atomstrukturen af individuelle molekyler i deres cellulære miljø. Vi opnår dette ved at udnytte kvantecomputerteknologi i et koncept, der bringer magnetisk resonansbilleddannelse til atomskalaen."
Det foreslåede billeddannelsessystem består af en atomær qubit, der er placeret omkring 2 nanometer under en overflade, der holder det molekyle, der skal afbildes. Qubit'en fungerer som både kilden og sensoren for magnetiske felter, med dets kvantemagnetiske egenskaber (dens spin), der interagerer med de magnetiske egenskaber af atomerne i målmolekylet. Ved at indsamle data om disse interaktioner i forskellige retninger, systemet kunne bestemme positionerne af individuelle atomer og konstruere et 3D-billede af målmolekylets struktur.
Forskerne simulerede den nye teknik ved hjælp af et rapamycinmolekyle (C 51 H 79 INGEN 13 ), et immunsuppressivt lægemiddel, der almindeligvis bruges til at forhindre afstødning af organtransplantater. I konventionelle billedbehandlingsteknikker, såsom røntgenkrystallografi, det er svært at påvise brintatomerne. Men ved at måle brintkernespindensiteten, nano-MRI-metoden kan generere 3D-billeder af brintatomerne, samt kulstofatomer, med en gennemsnitlig billedopløsning på ångstrøm-niveau.
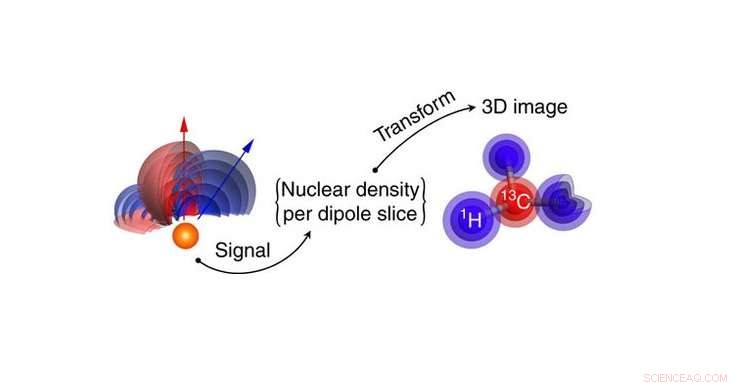
Målmolekylets nukleare tæthed omdannes til et 3D nuklear densitetsbillede af brint og kulstofatomer. Atompositioner udvindes direkte fra densitetsbilleddataene. Kredit:Perunicic et al., Naturkommunikation
"Evnen til at afbilde molekylernes atomare struktur i deres oprindelige cellulære miljøer er afgørende for både at forstå sygdommens oprindelse og finde dens helbredelse, " sagde Hollenberg. "F.eks. i søgningen og afprøvningen af nye lægemidler ville man først identificere et mål, ofte et membranprotein. Billeddannelse af den sande struktur af proteinet i det cellulære miljø er nøglen til at forstå, hvordan lægemiddelmolekyler vil interagere med det. På baggrund af disse oplysninger, et lægemiddelmolekyle kunne vælges eller designes. Vigtigt, den samme billeddannende enhed ville give midler til at forstå og teste, hvor godt lægemidlet virker, ved at observere dets interaktioner med målmolekylet på atomniveau. Vores mål er at udvikle en alsidig teknologi til at observere den i øjeblikket utilgængelige biokemiske atomstruktur af vigtige molekyler in situ, analogt med, hvordan hospitals-MR-maskiner observerer vores kroppes anatomi."
På grund af den store mængde data, der er involveret, simuleringer viser, at den samlede tid til at generere et billede af rapamycin-molekylet i øjeblikket er omkring 175 timer. Imidlertid, forskerne forventer, at fremtidige forbedringer vil reducere denne tid betydeligt, samt øge opløsningen yderligere. I fremtiden, de planlægger også at opskalere systemdesignet til billeddannelse af større biomolekyler.
"Hidtil har vores arbejde fokuseret på det grundlæggende teoretiske grundlag, at forstå, hvordan man fysisk konstruerer enheden med aktuelt tilgængelig teknologi, " sagde Perunicic. "Vi er ved at udvikle den indviklede kvantemekaniske kontrol, der ville give kapaciteten til at afbilde individuelle molekyler, og udfører også simuleringer for at teste ydeevnen under realistiske forhold. Da resultaterne af disse undersøgelser var opmuntrende, den naturlige retning for de næste par år er at vove sig ud i eksperimentelle proof-of-concept demonstrationer."
© 2016 Phys.org
 Varme artikler
Varme artikler
-
 Gennembrud inden for ultrahurtig databehandling i nanoskalaEt forskerhold ledet af lektor Christian Nijhuis fra Kemisk Institut på NUS Det Naturvidenskabelige Fakultet (anden fra højre) har for nylig opfundet en ny konverter, der kan udnytte plasmons hastighe
Gennembrud inden for ultrahurtig databehandling i nanoskalaEt forskerhold ledet af lektor Christian Nijhuis fra Kemisk Institut på NUS Det Naturvidenskabelige Fakultet (anden fra højre) har for nylig opfundet en ny konverter, der kan udnytte plasmons hastighe -
 Termotropiske fasegrænser i klassisk ferroelektrisk(venstre) Nanoskala scanning røntgendiffraktion rumligt kort over (220) Mc-toppen i BaTiO3 og (højre) diffraktionsbillede af sted 2; skala bar 8 um. Dette projektionsbillede er af hele strukturen, der
Termotropiske fasegrænser i klassisk ferroelektrisk(venstre) Nanoskala scanning røntgendiffraktion rumligt kort over (220) Mc-toppen i BaTiO3 og (højre) diffraktionsbillede af sted 2; skala bar 8 um. Dette projektionsbillede er af hele strukturen, der -
 Nanokamera fremstillet ved hjælp af molekylær lim tillader overvågning af kemiske reaktioner i re…Enheden, lavet af et team fra University of Cambridge, kombinerer bittesmå halvledernanokrystaller kaldet kvanteprikker og guldnanopartikler ved hjælp af molekylær lim kaldet cucurbituril (CB). Når de
Nanokamera fremstillet ved hjælp af molekylær lim tillader overvågning af kemiske reaktioner i re…Enheden, lavet af et team fra University of Cambridge, kombinerer bittesmå halvledernanokrystaller kaldet kvanteprikker og guldnanopartikler ved hjælp af molekylær lim kaldet cucurbituril (CB). Når de -
 Opbygning af 3-D fraktaler på en nanoskalaFraktal struktur efter fire trin. Det starter med én 3D-struktur med otte planer, et oktaeder. Dette gentager sig til mindre oktaedre:625 efter kun fire trin. Ved hvert hjørne af et nyt oktaeder,
Opbygning af 3-D fraktaler på en nanoskalaFraktal struktur efter fire trin. Det starter med én 3D-struktur med otte planer, et oktaeder. Dette gentager sig til mindre oktaedre:625 efter kun fire trin. Ved hvert hjørne af et nyt oktaeder,
- Hvad sker der med ioniske og kovalente forbindelser, når de opløses i vand?
- Trofiske niveauer af koralrev
- Knæk hemmelighederne bag dinosaurernes æggeskaller
- Den nemmeste måde at lære apotek Math
- Billede:ESA fremdriftslaboratorier testbænk for vandhammer
- Hollywoods guldalder var ikke så gylden for kvinder


