Nyt aspekt af atommimik til nanoteknologiapplikationer
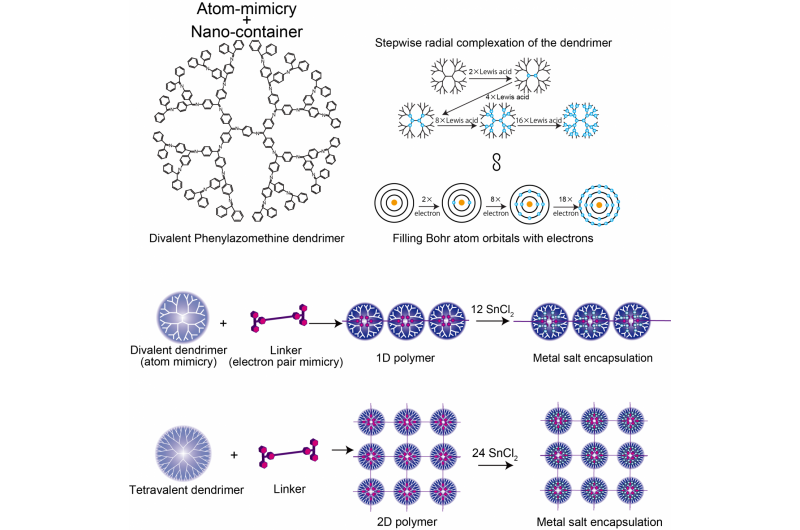
Strukturen af divalent phenylazomenthin dendrimer, Sammenligning af DPA og Bohr atommodellen, og 1D/2D supramolekylær polymer. Kredit:Tokyo Institute of Technology
Inden for nanoteknologi er kontrol nøglen. Kontrol over arrangementer og afstande mellem nanopartikler kan tillade skræddersyede interaktionsstyrker, så egenskaber kan udnyttes i enheder såsom plasmoniske sensorer. Nu bruger forskere ved Tokyo Institute of Technology dendrimerer, der efterligner atomers elektronvalens og forbinder dem til arrays ved hjælp af molekyler, der koordinerer med dendrimeren, da de ville danne et kovalent elektronpar i deres valensskal - "elektronparmimik".
Kimihisa Yamamoto, Ken Albrecht, og kolleger ved Tokyo Tech overvejede dendritiske polyphenylazomethine (DPA), som har en struktur, der forgrener sig fra en central kerne. "Lewis-syre"-molekyler koordinerer til "Lewis-base"-stederne i DPA. Analyse af forholdet mellem SnCl2 Lewis-syremolekyler, der koordinerer med hver dendrimer, afslørede trinstigninger fra 2 til 4 til 8 til 16, som efterligner valensen af Bohr-atomet, der har 2, 8, 18, og 32 elektroner i 1. 2., 3., og 4. orbitaler. Dette afspejler stigningen i antallet af molekyler, der kan koordinere med dendrimeren med stigende afstand fra kernen, efterhånden som antallet af dendrimergrene og elektrondensiteten stiger.
Yamamotos team analyserede koordineringen af DPA med en stærkere bindende Lewis-syre - triphenylmethylium (TPM) - bundet til det stavlignende molekyle phenylene ethynylen. Phylen-ethynlen-rygraden er stiv nok til, at sure kationer i hver ende ikke derefter kan binde til den samme dendrimer. I stedet dannes en polymerkæde af dendrimerer. Brug af en anden startdendrimer (ZnPG4 i stedet for DPAG4) - som har en kernevalens på fire i stedet for to - førte til dannelsen af todimensionel polymerisation af dendrimererne, producerer et 2D-array af nanocontainere, der kan akkumulere andre Lewis-syrer i de ydre orbitaler.
Arbejdet beskriver "et nyt aspekt af atommimik", konkluderer forskerne. "Geometrien og tonehøjden kan styres af designet af dendrimeren og linkeren og er potentielt anvendelige til plasmonics (efter frø-medieret vækst) og nanoelektrodegitre (som også er nyttige som elektrokatalysatorer)."
Undersøgelsen er publiceret i Videnskabens fremskridt .
Bohr atom
Bohr-modellen af atomet opstillet af Niels Bohr og Ernest Rutherford i 1913 beskriver atomet som en positiv kerne omgivet af elektroner i forskellige skaller eller energiniveauer. Hver skal har et foreskrevet antal elektroner, der kan optage den - dvs. to elektroner kan optage den første skal, otte den næste, og atten den næste, og så videre.
Selvom der er aspekter af atomets adfærd, som modellen ikke dækker, den er særlig vellykket til at forklare de spektrale emissionslinjer. Når man er spændt, en elektron kan hoppe til næste energiniveau. Når det vender tilbage til det oprindelige energiniveau, forskellen i energierne udsendes som lys ved den specifikke bølgelængde, der svarer til energiforskellen.
Hvor en skal ikke er fuld, atomet kan binde sig til en anden kemisk art. På denne måde beskriver et atoms valens, hvor fuld elektronskallen er, og hvor let bindinger kan dannes. Elektrondensitetsgradienten af dendrimerer, der bevæger sig radialt fra kernen til de mere forgrenede ydre regioner, dikterer, hvor mange Lewis-syre-koordinerende molekyler den kan rumme, og på denne måde efterligner den Bohr-atomets energiniveauer.
Hvad er en Lewis-syre
En Lewis-syre er en kemisk art, der kan acceptere et ensomt elektronpar fra et kemikalie, der kan donere et ensomt par, det er, fra en Lewis-base. Denne adfærd er defineret af kemikaliets elektronstruktur. Lewis-syrer omfatter sure forbindelser, men også metalkationer.
Når dendrimeren koordinerer med Lewis-syrerne, træder den i stedet for Lewis-basen, der ville donere et elektronpar. Forskerne beskriver di-Lewis-syreforbindelsen (linker-molekyle) som elektronpar-mimik.
Isobestiske punkter
Når to kemikalier reagerer, kan mængden af absorberet lys ændre sig afhængigt af, hvor meget lys produkterne kontra reaktanterne absorberer. Hvis produkterne og reaktanterne absorberer den samme mængde lys ved en bestemt bølgelængde, det beskrives som det isosbestiske punkt.
Forskerne brugte isosbestiske punkter til at identificere de trinvise stigninger i Lewis-syre, der reagerer med dendrimererne. Et bølgelængdeskift i det isosbestiske punkt indikerer koordinering af Lewis-syren til det efterfølgende lag af dendrimeren.
 Varme artikler
Varme artikler
-
 Advance muliggør muligvis 2D-transistorer til mindre mikrochipkomponenterVed grænsefladen mellem semimetallet (vismut) og 2D-halvlederen (MoS2), der er ingen energibarriere for elektronen at gå igennem, hvilket fører til en ultralav kontaktmodstand mellem dem. Kredit:Massa
Advance muliggør muligvis 2D-transistorer til mindre mikrochipkomponenterVed grænsefladen mellem semimetallet (vismut) og 2D-halvlederen (MoS2), der er ingen energibarriere for elektronen at gå igennem, hvilket fører til en ultralav kontaktmodstand mellem dem. Kredit:Massa -
 Nanostrukturerede tynde film, der kan bøje lys i store vinkler, kan være en erstatning for omfangs…En metaflade med fiskelignende elementer omdirigerer en indkommende lysstråle i en ny retning. Kredit:A*STAR Data Storage Institute Overflader, der effektivt omdirigerer lysets udbredelse, er blev
Nanostrukturerede tynde film, der kan bøje lys i store vinkler, kan være en erstatning for omfangs…En metaflade med fiskelignende elementer omdirigerer en indkommende lysstråle i en ny retning. Kredit:A*STAR Data Storage Institute Overflader, der effektivt omdirigerer lysets udbredelse, er blev -
 Hvorfor nanoteknologi er mere end bare et modeordFarven på guld nanopartikler i suspension varierer alt efter størrelsen af nanopartiklerne. Kredit:Valeg96, CC BY Hvad formoder ordet nanoteknologi for dig? Jeg har brugt den bedste del af en u
Hvorfor nanoteknologi er mere end bare et modeordFarven på guld nanopartikler i suspension varierer alt efter størrelsen af nanopartiklerne. Kredit:Valeg96, CC BY Hvad formoder ordet nanoteknologi for dig? Jeg har brugt den bedste del af en u -
 Forskere identificerer adfærd af nanopartikler, der viser lovende som nanofødningUD-forskere (fra venstre) Deb Jaisi, Yan Jin og Dengjun Wang har opdaget unikke adfærd af hydroxyapatit-nanopartikler, der viser lovende som en fosfor-nanogødning og kan bruges til at hjælpe med at br
Forskere identificerer adfærd af nanopartikler, der viser lovende som nanofødningUD-forskere (fra venstre) Deb Jaisi, Yan Jin og Dengjun Wang har opdaget unikke adfærd af hydroxyapatit-nanopartikler, der viser lovende som en fosfor-nanogødning og kan bruges til at hjælpe med at br
- Ny undersøgelse kaster lys over teenageres onlinevaner
- En bedre måde at indkapsle øceller til diabetesbehandling
- En våd vinter, et fugtigt forår:Den negative dipol i Det Indiske Ocean
- Vejrmønstre i Deserts
- Forskere udvikler 3D-printbart materiale, der efterligner biologiske væv
- Det sydlige Californiens Getty-brand fortsætter med at brænde


