Dødelig nanoparcel til kræftceller
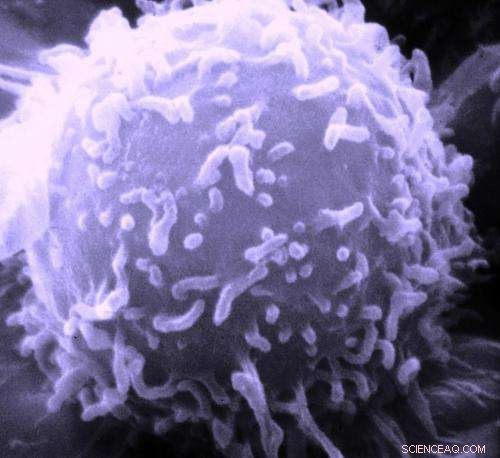
Elektronmikroskopisk billede af en enkelt human lymfocyt. Kredit:Dr. Triche National Cancer Institute
De fleste tumorer indeholder områder med lav oxygenkoncentration, hvor cancerterapier baseret på virkningen af reaktive oxygenarter er ineffektive. Nu, Amerikanske videnskabsmænd har udviklet et hybridt nanomateriale, der frigiver et fri-radikal-genererende prodrug inde i tumorceller ved termisk aktivering. Som de beretter i journalen Angewandte Chemie , de frie radikaler ødelægger cellekomponenterne selv under iltfattige forhold, forårsager apoptose. Levering, frigøre, og hybridmaterialets virkning kan styres præcist.
Mange veletablerede kræftbehandlingsordninger er baseret på generering af reaktive oxygenarter (ROS), som inducerer apoptose for tumorcellerne. Imidlertid, denne mekanisme virker kun i nærværelse af ilt, og hypoxiske (iltfattige) områder i tumorvævet overlever ofte den ROS-baserede behandling. Derfor, Younan Xia ved Georgia Institute of Technology og Emory University, Atlanta, USA, og hans team har udviklet en strategi for at levere og frigive et radikalgenererende prodrug, der, ved aktivering, beskadiger celler ved en radikal mekanisme af ROS-typen, men uden behov for ilt.
Forfatterne forklarede, at de var nødt til at vende sig til området polymerisationskemi for at finde en forbindelse, der producerer nok radikaler. der, azoforbindelsen AIPH er en velkendt polymerisationsinitiator. I medicinske anvendelser, det genererer frie alkylradikaler, der forårsager DNA-skade og lipid- og proteinperoxidation i celler, selv under hypoxiske forhold. Imidlertid, AIPH skal leveres sikkert til cellerne i vævet. Dermed, forskerne brugte nanocages, hvis hulrum var fyldt med laurinsyre, et såkaldt faseændringsmateriale (PCM), der kan tjene som bærer for AIPH. Når først er inde i målvævet, bestråling med en nær-infrarød laser opvarmer nanocages, forårsager PCM til at smelte og udløser frigivelse og nedbrydning af AIPH.
Dette koncept fungerede godt, som holdet har vist med en række eksperimenter på forskellige celletyper og komponenter. Røde blodlegemer gennemgik udtalt hæmolyse. Lungekræftceller inkorporerede nanopartiklerne og blev alvorligt beskadiget af den udløste frigivelse af den radikale starter. Aktinfilamenter trukket tilbage og kondenserede efter behandlingen. Og lungekræftcellerne viste betydelig hæmning af deres væksthastighed, uafhængigt af iltkoncentrationen.
Selvom forfatterne indrømmer, at "effektiviteten stadig skal forbedres ved at optimere de involverede komponenter og betingelser, "de har demonstreret effektiviteten af deres hybridsystem til at dræbe celler, også på steder, hvor iltniveauet er lavt. Denne strategi kan være yderst relevant inden for nanomedicin, kræftterapi, og i alle applikationer, hvor målrettet levering og kontrolleret frigivelse med fremragende rumlige/tidsmæssige opløsninger ønskes.
 Varme artikler
Varme artikler
-
 Sigtning af ioner med en polymermembranDen innovative polymermembran udviklet af KAUST-forskere har et stort potentiale i mange energi- og miljørelaterede ionseparationsprocesser. Kredit:© Tilpasset fra Zhou et al. 2021. Ionsigtende po
Sigtning af ioner med en polymermembranDen innovative polymermembran udviklet af KAUST-forskere har et stort potentiale i mange energi- og miljørelaterede ionseparationsprocesser. Kredit:© Tilpasset fra Zhou et al. 2021. Ionsigtende po -
 Hemmeligheden bag 3D-grafen? Bare frys det3-D grafen skabt af et internationalt forskerhold ledet af Unversity at Buffalo ingeniører. Kredit:University at Buffalo. Grafen er et vidundermateriale med store forventninger. Opdaget i 2004, de
Hemmeligheden bag 3D-grafen? Bare frys det3-D grafen skabt af et internationalt forskerhold ledet af Unversity at Buffalo ingeniører. Kredit:University at Buffalo. Grafen er et vidundermateriale med store forventninger. Opdaget i 2004, de -
 Lys udløser guld på uventet visRice University-forskere, der studerer lysets effekt på pinwheels (venstre) og enkelt C-formede (højre) guldnanopartikler, har fundet en ukendt effekt på enkelte partikler. At stimulere partiklerne he
Lys udløser guld på uventet visRice University-forskere, der studerer lysets effekt på pinwheels (venstre) og enkelt C-formede (højre) guldnanopartikler, har fundet en ukendt effekt på enkelte partikler. At stimulere partiklerne he -
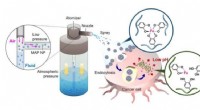 Kemospray kan være et alternativ til konventionel kemoterapiNanopartikler, der indeholder kemoterapi-lægemidler og biokonstrueret muslingeklæbende protein, sprøjtes på vævsoverfladen af kræftceller efter operation, muliggør stedstyret og lokaliseret anticanc
Kemospray kan være et alternativ til konventionel kemoterapiNanopartikler, der indeholder kemoterapi-lægemidler og biokonstrueret muslingeklæbende protein, sprøjtes på vævsoverfladen af kræftceller efter operation, muliggør stedstyret og lokaliseret anticanc
- Næsten 120, 000 fordrevne i Myanmar oversvømmelser
- Havbakterier i canadisk arktisk stand til at nedbryde diesel og olie
- Forskere laver nye opskrifter til at tage salt ud af havvand
- Forskerhold identificerer anden-harmonikgenerationsinterferens i 2-D heterobilag
- Ny laser, der hjælper med at rense himlen for rumaffald
- Mælkevejenes mest mystiske stjerne fortsætter med at forvirre


