Tyktarmskræft nuklear pore-dynamik fanges af HS-AFM
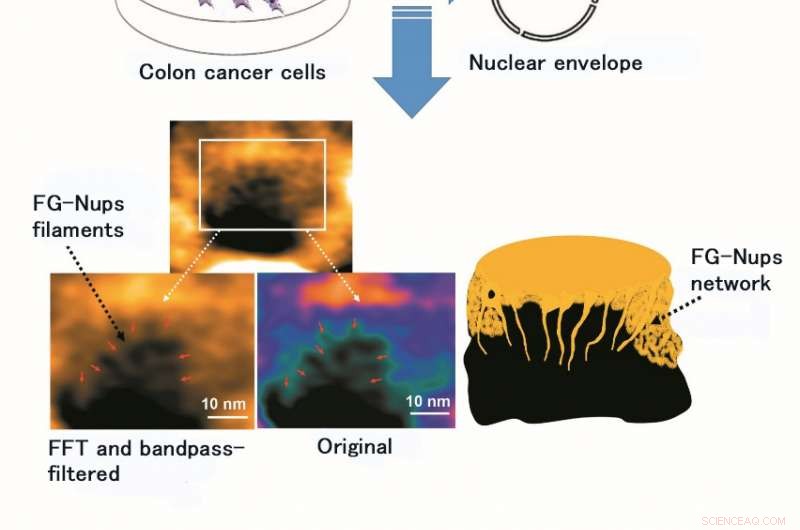
Udnyttelse af HS-AFM muliggjorde observation og video-billeddannelse af struktur og dynamik af FG-Nups filament, et proteinkompleks af blød og fleksibel foring. Figuren viser det originale billede af FG-Nups filament og det efter behandling med Fast Fourier Transform (FFT) og et båndpasfilter (et båndpasfilter tillader kun gennemtrængning af bestemt bølgelængde lys). Kredit:Kanazawa University
En af de vigtigste årsager til kræftdødelighed er kræftcellernes meget invasive adfærd, hvilket ofte skyldes aggressive metastaser. Metastase lettes af forskellige vækstfaktorer og cytokiner, der udskilles fra celler i immunsystemet, som fungerer gennem forskellige signalveje. Bemærkelsesværdigt, disse signalveje kommer ind i kernen gennem det nukleare porekompleks (NPC), som formodes at fungere som dørvogter til kernen. NPC er, faktisk, en nanomaskine bestående af flere kopier af omkring 30 forskellige proteiner, samlet kaldet nukleoporin.
Selvom små molekyler er i stand til at gå gennem de nukleare porer ret frit, molekyler større end 40 kDa kunne kun gøre det effektivt ved at binde til specifikke transporterproteiner, der interagerer med FG-Nups (nukleoporiner har gentagne enheder af to aminosyrer phenylalanin (F) og glycin (G), som er de tentakelproteiner, der har specifikke og udvælgende roller i poretransport. Selvom der foreslås forskellige modeller, hvordan FG-Nups deltager i kerne-cytoplasma-transporten forbliver stort set ukendt. Ikke desto mindre, den samtidige vurdering af nanoskopiske strukturer og dynamikker har været teknisk umulige, en situation, der gør sig gældende i hele cellebiologiske forskning. Den direkte visualisering af NPC-dynamik ved opløsning i nanoskala blev anset for at være umulig.
Forskerholdet fra Kanazawa University undersøgte dette vigtige spørgsmål og opnåede de banebrydende resultater ved kombineret højopløsnings levende cellebilleddannelse, elektronmikroskopi, og high-speed AFM (HS-AFM), som er udviklet af dem selv til at undersøge den native nanoskopiske rumlige og tidsmæssige dynamik i NPC-strukturer i tyktarmskræftcellerne.
Først, de genererede NPC stabile cellelinjer, der udtrykte GFP (grønt fluorescerende protein) og bekræftet ved fluorescerende mikroskopi. Næste, de isolerede den højt oprensede nukleare kappe, hvilket blev bekræftet ved brug af negativ farveelektronmikroskopi og konfokalmikroskopi. Derefter, de startede observationen af spatiotemporale ændringer på millisekunder og nanometerskala af NPC-struktur i tyktarmskræftceller ved at kombinere højopløsnings levende cellebilleddannelse og elektronmikroskopi. Især de udførte observation af levende nuklear kappe og nukleare porer ved hjælp af HS-AFM.
Forskerholdet fra Kanazawa University var, Ja, succes med at afbilde dynamikken af NPC-proteiner i kræftceller, som er byggestenene i den nukleare pore (Figur 1). MLN8237/alisertib, en apoptotisk og autofagisk inducer, gennemgår i øjeblikket flere kliniske kræftforsøg. Dette lægemiddel blev rapporteret at hæmme nukleoporinekspression og aktiviteter. Forskerne visualiserede indfødte og lægemiddelbehandlede FG-Nups af HS-AFM. I særdeleshed, de forlængede og tilbagetrukne FG-Nups med et spindelvævsudseende gik tabt i lægemiddelbehandlede prøver (figur 2). Forskerholdet konkluderede, at via HS-AFM, de visualiserede deformationen og tabet af FG-Nups nuklear porebarriere, som måske er den første nano-døende kode opdaget i verden.
Den nuværende undersøgelse af forskerholdet fra Kanazawa University muliggjorde visualisering af struktur og dynamik i kernemembranporen på nanometerskala, og det er vist, at deformation og tab af kernemembranens porebarriere ville være en af de døende koder for cancerceller. Disse resultater står for et nyt paradigme i vores forståelse af nuklear transport, som har, indtil dette punkt, forblev et gådefuldt problem inden for nanomedicin og cellebiologi. Nuværende resultater er baseret på kronen på bio-billeddannelsesteknologien udviklet ved Kanazawa University. Denne undersøgelse har medicinske anvendelser, herunder at fungere som en ny "nano-endoskopi" til at visualisere intracellulære organeller såsom kernen og nukleare porer, og molekylær dynamik i kræftceller og andre sygdomme.
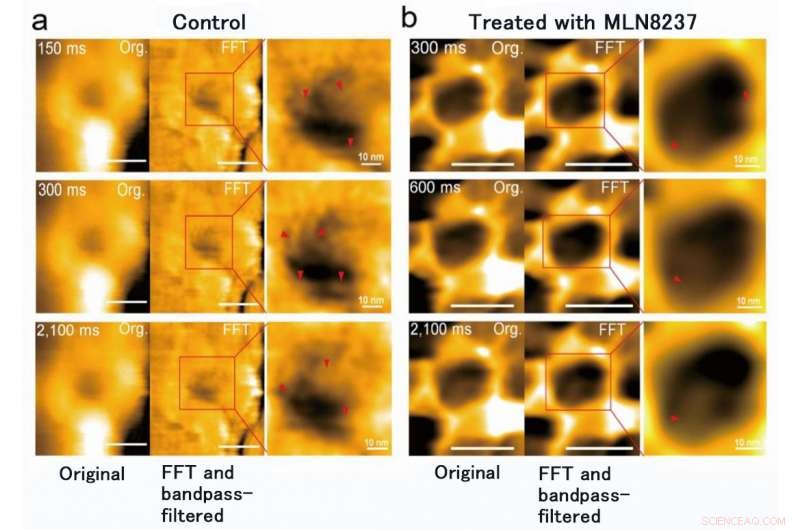
MLN8237 behandling af cancerceller forårsagede deformation og tab af FG-Nups barriere. Det blev også fundet, at den indre diameter af den nukleare pore ændrede sig fra 86 ± 13 nm til 53 ± 9 nm og dybden, fra 4 ± 2 nm til 7 ± 1 nm. Kredit:Kanazawa University
Sidste artikelForskere producerer dialysemembran lavet af grafen
Næste artikelOptiske nanomotorer:Små motorer drives af lys
 Varme artikler
Varme artikler
-
 Syntetisk nano-affald forsvinder ikkeIkke-nedbrydelige nanopartikler binder sig til faste rester som følge af forbrænding af affald og kan dermed finde vej til miljøet. Afbildet:affaldsforbrændingsanlægget Emmenspitz. Kredit:Tobias Walse
Syntetisk nano-affald forsvinder ikkeIkke-nedbrydelige nanopartikler binder sig til faste rester som følge af forbrænding af affald og kan dermed finde vej til miljøet. Afbildet:affaldsforbrændingsanlægget Emmenspitz. Kredit:Tobias Walse -
 Nye metal-organiske nanoplader udviklet til korrosionsbeskyttelseFremstilling af MOF nanosheets via traditionelle vs. overfladeaktive midler-assisteret metoder. Kredit:NIMTE Den marine funktionelle materialegruppe ledet af prof. Wang Liping ved Ningbo Institute
Nye metal-organiske nanoplader udviklet til korrosionsbeskyttelseFremstilling af MOF nanosheets via traditionelle vs. overfladeaktive midler-assisteret metoder. Kredit:NIMTE Den marine funktionelle materialegruppe ledet af prof. Wang Liping ved Ningbo Institute -
 Topologisk smeltning af en krystalØverste panel:spin -konfiguration af en skyrmion. Nedre panel:Voronoi tessellation af repræsentative skyrmion gitterkonfigurationer i det faste, henholdsvis den hexatiske og den flydende fase. Kredit:
Topologisk smeltning af en krystalØverste panel:spin -konfiguration af en skyrmion. Nedre panel:Voronoi tessellation af repræsentative skyrmion gitterkonfigurationer i det faste, henholdsvis den hexatiske og den flydende fase. Kredit: -
 Nanoskala billeddannelse af stamme ved hjælp af X-ray Bragg projektion ptychography(Top) Fokuserede strålekohærente røntgen-nanodiffraktionsmønstre indsamlet fra en SiGe-on-SOI-prototype-enhedskant og (midt og bund) projiceret belastningsfelt rekonstrueret ved ptykografiske metoder.
Nanoskala billeddannelse af stamme ved hjælp af X-ray Bragg projektion ptychography(Top) Fokuserede strålekohærente røntgen-nanodiffraktionsmønstre indsamlet fra en SiGe-on-SOI-prototype-enhedskant og (midt og bund) projiceret belastningsfelt rekonstrueret ved ptykografiske metoder.
- Målrettede nanopartikler, der kombinerer billeddannelse med to forskellige terapier, kan angribe kr…
- Kunsten og videnskaben i japanerne cherry blossom prognose
- Relationel mobilitet kan påvirke din interpersonelle adfærd
- NASA finder den tropiske storm Rene mindre påvirket af vindskæring
- Sådan laver du DNA-modeller ved hjælp af papir
- Forskere slukker backscattering, sigte på at forbedre optisk datatransmission


