Lyser på genregulering
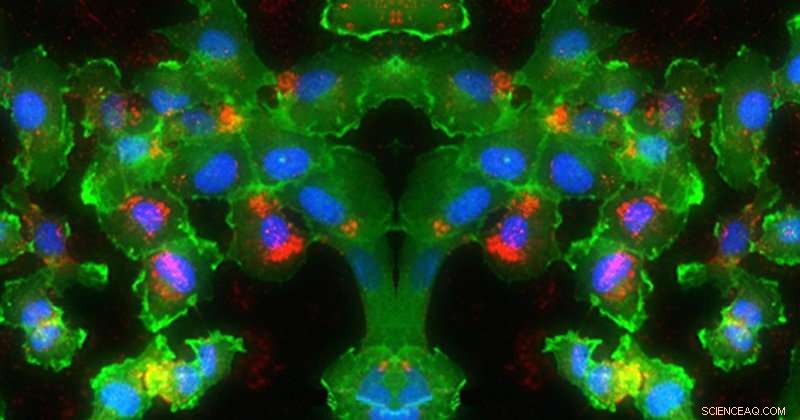
På dette billede, RNA (rød) leveres ind i cellekerne (blå) (grøn). Kredit:University of Delaware, Evan Krape, Emily Day og Joy Smoker
Kræftbehandlinger - fra stråling til kirurgi til kemoterapi - er designet til at fjerne eller dræbe kræftceller, men raske celler bliver ofte til sideskader i processen. Hvad hvis du kunne bruge lasere til at lokalisere behandlingsområdet og kun levere medicin til kræftceller?
Et forskerhold ved University of Delaware, ledet af Emily Day, en adjunkt i biomedicinsk teknik, lægger grunden til en metode til at hæmme kræftfremmende gener i kræftceller og samtidig efterlade sunde celler intakte. I et nyt blad udgivet i Nano bogstaver , holdet afslører hidtil uset indsigt i denne lovende metode, som involverer belægning af nanopartikler med genregulerende midler og derefter udsættelse af dem for en dosis laserlys for at frigøre dette materiale.
Fordi nanopartiklerne holder de genregulerende midler inaktive, indtil deres frigivelse udløses on-demand med lys, de har et betydeligt potentiale til at muliggøre kræftbehandling med høj præcision og samtidig minimere indvirkningen på ikke-bestrålede raske celler. Day og hendes team testede deres nye metode mod hjernetumorceller ved at bruge nanopartiklerne til at dæmpe ekspressionen af grønt fluorescerende protein (GFP) i cellerne.
En ny måde at kombinere lasere og nanopartikler
Ligesom skalpeller og suturer, lasere bruges ofte i medicinske procedurer. Øjenlæger bruger lasere til at omforme hornhinder ved synskorrigerende øjenkirurgi. Dermatologer bruger lasere til at falme ar på huden. Kardiologer bruger lasere til at åbne tilstoppede arterier. Onkologer bruger lasere til at ødelægge kræftceller og tumorer.
Day Lab har til formål at kombinere lasere med lys-responsive genregulerende nanopartikler for strategisk at udslette kræftceller og minimere sideskader.
De starter med små interfererende RNA'er, kendt som siRNA'er, som er molekyler bestående af komplementære RNA-strenge, der kan reducere ekspressionen af visse gener i kræftceller. siRNA'erne er coatet på nanopartikler lavet af silica og guld, som måler mindre end bredden af et menneskehår. Disse partikler beskytter siRNA'erne, indtil de når det ønskede behandlingsområde. Spørgsmålet er - hvordan frigiver du dem på det helt rigtige sted?
"Tidligere hvis folk ville levere RNA med nanopartikler, de kan belægge nanopartiklerne med en polymer eller cellegennemtrængende peptid, et middel til at lette celleoptagelse og levering, " sagde Day. "Problemet er, at de agenter ikke er specifikke. Du ender med at få genregulering i alle celler, ikke kun de kræftceller, du havde til hensigt at målrette mod genregulering."
Det er her præcisionen af lasere kommer ind i billedet.
"Lysudløst siRNA-frigivelse gør det muligt for dig kun at dæmpe gener, hvor partiklerne og lyset er kombineret, " sagde Day. "Da du vælger, hvor lyset skal hen, og dermed hvor siRNA frigives, du kan opnå meget specifik gendæmpning i tumorceller, reducerer potentialet for effekter uden for målet."
Til disse eksperimenter, Day og hendes team (ledet af Institut for Biomedicinsk Teknik kandidatstuderende Rachel Riley) udsatte de siRNA-coatede nanopartikler for enten kontinuerligt bølgelys eller korte lysimpulser administreret hver en kvadrilliontedel af et sekund. Begge typer bestråling udløste frigivelsen af siRNA i dobbeltstrengede og enkeltstrengede former, hvilket kom som en overraskelse, da tidligere undersøgelser i den videnskabelige litteratur antydede, at kontinuerlig bølgebestråling kun ville frigive enkelte strenge af siRNA (hvilket betyder, at de to komplementære strenge af siRNA'et adskilte fra hinanden, i stedet for at hele duplexen frigives fra nanopartikeloverfladen).
"Dette er første gang nogen har vist, at man kan få både siRNA-duplekser og enkeltstrenge af RNA til at frigive fra nanopartikler ved hjælp af en kontinuerlig bølgelaser som excitationskilde, sagde Day. "Men vores undersøgelser afslører også, at pulseret lys er meget mere effektivt til at frigive siRNA-duplekser end kontinuerligt bølgelys. Det er bydende nødvendigt, at primært duplekser frigives fra nanopartiklerne, fordi kun duplekseret siRNA vil fungere inde i celler for at dæmpe ekspression af de målrettede gener."
Dagen fortsatte, "Yderligere, vores undersøgelser viser, at pulserende lys ikke opvarmer celler, som kontinuerligt bølgelys gør. Dette er vigtigt, da for meget varme kan forårsage, at celler bliver beskadiget af andre mekanismer end den ønskede genregulering."
Hendes laboratoriegruppe er veludstyret til at afdække sådanne indsigter vedrørende mekanismen for lys-udløst RNA-frigivelse fra nanopartikler, fordi de udfører unik tværfaglig forskning.

Fra venstre, Margaret Billingsley, Emily Day, og Rachel Riley er vist arbejde på et af deres tidligere forskningsstudier, denne om opdagelse af kræft. Kredit:University of Delaware, Evan Krape, Emily Day og Joy Smoker
"Mit laboratorium har en masse ekspertise inden for RNA-levering og cancerbiologi, så vi har meget flere molekylærbiologiske færdigheder end et traditionelt nanoteknologilaboratorium måske har, og dette gør det muligt for os at studere funktionen af RNA-nanobærere med hidtil usete detaljer, " hun sagde.
Den nye indsigt, som Days forskning kaster om brugen af kontinuerligt bølgelys versus pulseret lys til udløst siRNA-frigivelse fra nanopartikler, er et vigtigt bidrag til feltet med lægemiddellevering. Ud over at demonstrere de funktionelle forskelle mellem de to former for lysexcitation, holdet viste også, at siRNA frigivet fra nanopartikler ved eksponering for pulserende lys reducerede ekspressionen af det målrettede gen (grønt fluorescerende protein) bedre end et kommercielt tilgængeligt materiale, der ofte bruges til at levere siRNA til celler i laboratorieeksperimenter. Dette var en spændende observation, der demonstrerede den potentielle virkning af dette nye system.
Dette arbejde er udført i samarbejde med Lars Gundlach i Institut for Kemi og Biokemi og Institut for Fysik og Astronomi ved UD, som ejer den pulserende laser, der blev brugt i disse eksperimenter. Der skal meget mere forskning til, før dette kan omsættes til en levedygtig behandling for kræftpatienter.
Hvad er det næste?
"Det næste skridt ville være at vise, at vi kan gøre dette med en mere funktionel og biologisk relevant RNA-last end siRNA-målrettet grønt fluorescerende protein, der blev brugt i dette arbejde, " Day said. "There are a lot of different genes that are known to control cancer growth, so we will deliver RNA that targets genes that we know to be important in tumor progression and see if we are delivering enough to have an impact."
The team is particularly interested in studying the delivery of siRNA targeting beta-catenin, which plays an important role in triple-negative breast cancer, and also the delivery of microRNA (which is similar to siRNA, but can regulate multiple genes simultaneously). For eksempel, Day's team hopes to deliver miR-34a, which is considered a master regulator of gene expression in cancer.
In addition to Day and Gundlach, the paper's authors include Rachel Riley, a doctoral student in the Department of Biomedical Engineering; Megan Dang, a doctoral student in Department of Biomedical Engineering; Maggie Billingsley, a senior undergraduate student in the Department of Biomedical Engineering; Baxter Abraham, a doctoral student in the Department of Chemistry and Biochemistry.
Riley, who will soon begin work as a postdoctoral associate at the University of Pennsylvania, started graduate school at UD because she wanted to do science that could make a real impact on the medical field. After losing an aunt to cancer, she was especially motivated to put her talents toward research that could someday help patients.
"The Day Lab's idea of incorporating nanoparticles for specific delivery of therapeutic agents was a really unique approach, " hun sagde.
Billingsley has done research in the Day Lab since her first year at UD and wrote three peer-reviewed papers based on her work in the group. In 2017, she was the first author on a paper published in PLOS One . Næste, Billingsley will attend graduate school at the University of Pennsylvania, where she will study immunotherapy. (She and Riley, a duo Day calls a "dream team, " could likely work together in the future.)
"When interviewing with graduate schools, this experience with The Day Lab was the main thing that helped me stand out in interviews and also understand what I wanted out of graduate school, " Billingsley said. "I have had so many opportunities to go down my own path and also work with others on new methods, ideas, and areas of research."
This paper also gave Billingsley a taste of an important aspect of scientific discovery.
"We found some results that conflicted with literature, which was a new experience for me, " she said. "That was more exciting that just confirming what was expected."
Samlet set, Day and her team are excited to further pursue this technology to reveal its potential as a high precision cancer therapy.
 Varme artikler
Varme artikler
-
 Fluorescerende peptid nanopartikler, i alle regnbuens farverPeptidnanopartikler lyser i forskellige regnbuens farver; hver række viser farverne udsendt for en serie af tre relaterede peptider. Kredit:Tilpasset fra ACS anvendte materialer og grænseflader 2020
Fluorescerende peptid nanopartikler, i alle regnbuens farverPeptidnanopartikler lyser i forskellige regnbuens farver; hver række viser farverne udsendt for en serie af tre relaterede peptider. Kredit:Tilpasset fra ACS anvendte materialer og grænseflader 2020 -
 Revolutionerende ny løsning til Semiconductor, Nano materialerSkematisk af hybrid core-shell vækstproces (PhysOrg.com) -- University of Maryland forskere har skabt en helt ny måde at producere højkvalitets halvledermaterialer, der er kritiske for avanceret m
Revolutionerende ny løsning til Semiconductor, Nano materialerSkematisk af hybrid core-shell vækstproces (PhysOrg.com) -- University of Maryland forskere har skabt en helt ny måde at producere højkvalitets halvledermaterialer, der er kritiske for avanceret m -
 Nanopartikler, lavet på bestilling - inde og udeForskere ved MIT og University of North Carolina skabte disse coatede nanopartikler i mange former og størrelser. Kredit:Forskerne En ny belægningsteknologi udviklet på MIT, kombineret med en ny n
Nanopartikler, lavet på bestilling - inde og udeForskere ved MIT og University of North Carolina skabte disse coatede nanopartikler i mange former og størrelser. Kredit:Forskerne En ny belægningsteknologi udviklet på MIT, kombineret med en ny n -
 Ny røntgenmikroskopiteknik afslører nanoskala hemmeligheder bag genopladelige batterierKunstnerisk gengivelse af lithium-ion batteripartikler under belysning af en fint fokuseret røntgenstråle. Kredit:Stanford University, Chueh gruppe Bedre batterier, der oplades hurtigt og holder l
Ny røntgenmikroskopiteknik afslører nanoskala hemmeligheder bag genopladelige batterierKunstnerisk gengivelse af lithium-ion batteripartikler under belysning af en fint fokuseret røntgenstråle. Kredit:Stanford University, Chueh gruppe Bedre batterier, der oplades hurtigt og holder l


