Glasagtige carbon-mikronåle:En ny transdermal medicinafgivelsesanordning
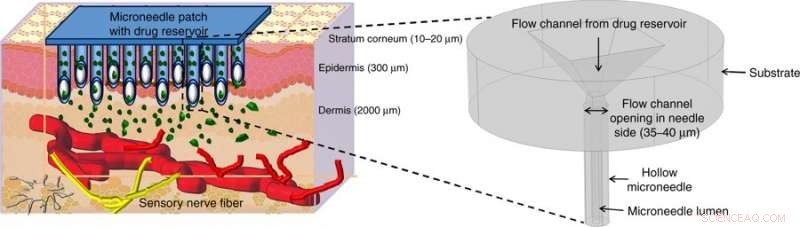
Illustreret lægemiddellevering ved hjælp af hule mikronåle (MN'er). Hule MN'er punkterer huden for at nå op over de smertefølende nerver i den transdermale region af huden og frigiver smertefrit lægemidlet gennem passende aktiveringsmetoder. Figuren i starten viser et forstørret billede af mikronålsstrukturen foreslået i dette arbejde. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9.
Mikronåle er designet til at infundere medicin transdermalt (gennem huden) og relativt smertefrit under kliniske applikationer. I en nylig undersøgelse, Richa Mishra og hendes kolleger udviklede en ny teknik til at omdanne polymerfilm til en brudbestandig glasagtig form for kulstof for at udvikle mikronåle. Den optimerede transdermale lægemiddelleveringsanordning blev fremstillet ved hjælp af fotolitografi for at danne en biokompatibel og robust mikronål til prækliniske applikationer.
Forskerne genererede først en række vertikale, hule rør fremstillet af den epoxybaserede polymer SU-8 på et siliciumsubstrat. Mikrostrukturerne blev skærpet til nålelignende former ved varmebehandling i en iltfri ovn, og slutproduktet var udelukkende sammensat af tilfældigt ordnede carbonatomer. Efterfølgende materialekarakterisering inkluderede nanoindentation for at måle overfladestivheden. De glasagtige kulstofstrukturer var robuste nok til at trænge ind i menneskelig hud uden at gå i stykker. Resultaterne af undersøgelsen blev offentliggjort på Mikrosystemer og nanoteknik .
Forfatterne detaljerede den konventionelle carbon-mikroelektromekaniske system (C-MEMS) proces, der bruges til at fremstille mikronålene. I processen, Mishra et al. brugt et skalerbart og irreversibelt pyrolysetrin, hvor forløberen for præ-mønstrede SU-8 mikronåle blev omdannet til glasagtige kulstofstrukturer. Eksperimenterne blev udført i en inert atmosfære ved høje temperaturer (~900 0 C) for at bevare deres oprindelige form efter krympning. Ved omdannelse til glasagtig kulstof, mikronålene arvede de tilknyttede egenskaber af hårdhed, biokompatibilitet, termisk og kemisk resistens.
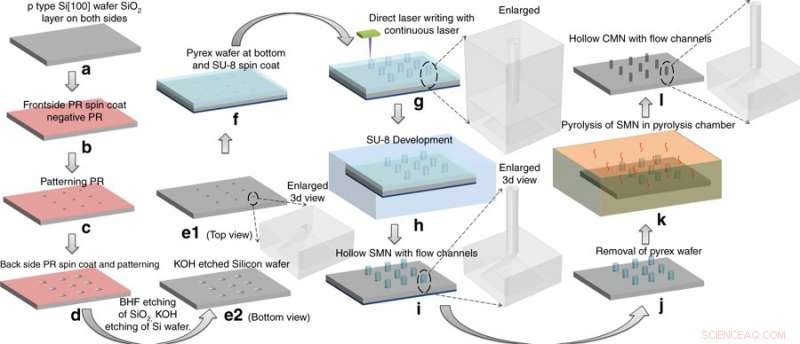
Fremstillingsproces:konvertering af SU-8 mikronåle (SMN'er) til hule glasagtige carbon-mikronåle (CMN'er) ved pyrolyse. SMN-strukturerne krympede, mens de bibeholdt deres overordnede geometri. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9
Forskerne sammenlignede hårdheden og Youngs modul af kulstof- og SU-8-mikronålene for at forstå øget styrke induceret af C-MEMS-processen. Strukturel krympning af kulstofmikronåle ved pyrolyse blev derefter estimeret. Mishra et al. udført dybdegående materialekarakterisering med energidispersiv røntgenspektroskopi (EDX) for at forstå overfladekemi og Raman-spektroskopi for at estimere atomprocenten af kulstof i mikronålens krystallinske struktur.
Resultaterne bekræftede den glasagtige sammensætning af mikronålene. Yderligere kompressions- og bøjningstests bestemte de maksimale kræfter, som mikronålene kunne modstå. Enhederne kunne modstå kræfter, der var cirka to størrelsesordener højere end modstandskræfterne i huden. Apparaterne blev efterfølgende testet på hudoverfladen af en musemodel i undersøgelsen.
Brugen af kulstof i medicin er ikke ny; eksempler omfatter applikationer i ortopædiske led, som kulfibre/kompositter i ortopædiske operationer og som materialer i kirurgiske instrumenter. Kulfibernes egenskaber til at danne 3-D stilladslignende strukturer har vist lovende kapacitet i knoglevævsregenerering. De skræddersyede egenskaber af carbon har gjort dem egnede til at fremstille transdermale lægemiddelleveringsmikronåle (MN) til avanceret lægemiddel- og vaccinelevering.
For kompetence, MN'er bør have en optimal længde for effektiv lægemiddellevering, men vær kort nok til at undgå at forårsage smerte. Materialeforskere udforsker strategier til at udvælge klinisk levedygtige materialer og metoder, der kan oversættes kommercielt på kort tid.
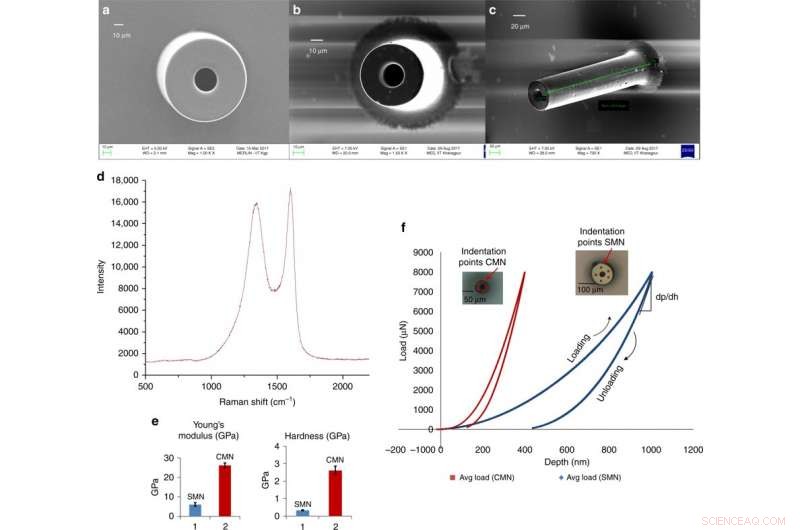
Glasagtige carbon-mikronåle til transdermal lægemiddellevering afledt af en skalerbar C-MEMS-proces. a) Scanningselektronmikrofotografi af et SMN (ydre diameter 100 μm, indvendig diameter 50 μm). b) Tilsvarende pyrolyseret MN. c) Vippet billede af samme CMN. d) Raman-spektrum af kulstofmikronålen. e) Sammenligning af Youngs modul og hårdhed for SU-8 og carbon MN'er. f) Belastning vs. forskydningsdata for et SMN og tilsvarende pyrolyseret CMN. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9.
Nøglekravene til MN'er omfatter biokompatibilitet, styrke og kontrolleret medicinafgivelse. Faste MN'er kan udvikles med polymerer, silicium, stål, titanium og nikkel via subtraktive eller additive processer. En ulempe ved faste MN'er er deres begrænsede kapacitet til optimal lægemiddellevering. På den anden side, hule MN'er kan fastgøres til et lægemiddelreservoir med eksternt tryk for optimal lægemiddellevering.
Mishra et al. valgte precursoren SU-8 for dens høje tværbindingsstyrke, biokompatibilitet, lavpris, lysinduceret polymerisation og kompatibilitet med den mikroelektroniske industriproces. At fremstille hul, glasagtige kulstofmikronåle (CMN'er), C-MEMS-processen blev først tilpasset til mønster SU-8 mikronåle (SMN'er) ved hjælp af direkte laserskrivning, efterfulgt af deres omdannelse til glasagtige CMN'er via pyrolyse. Mikrofluidporte blev ætset i en siliciumwafer, ifølge en tidligere protokol udviklet af det samme forskerhold. De resulterende produkter (CMN'er) blev karakteriseret for deres mekaniske egenskaber, herunder hårdhed og Youngs modul i sammenligning med deres forstadier SMN'er. Resultaterne indikerede, at CMN'er var overlegne.
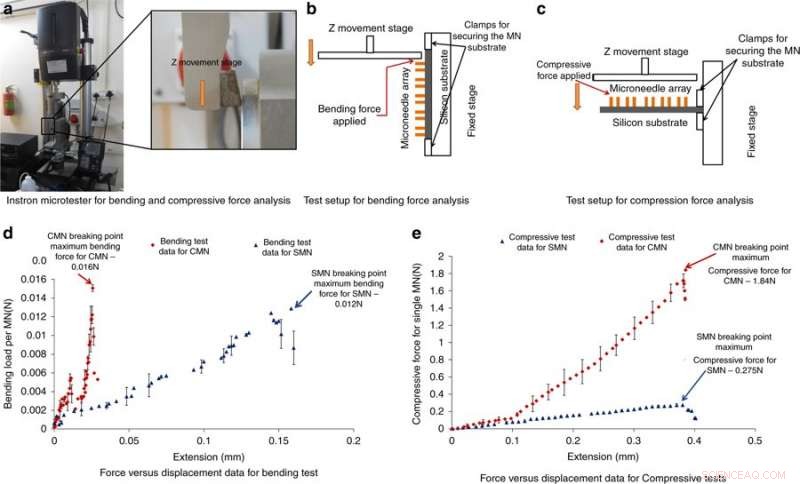
Instron mikrotester til bøjnings- og trykkraftanalyse og resultater. a) Fotografi af Instron-mikrotesteren anvendt til bøjnings- og trykkraftanalyse. b) Testopsætning til bøjningskraftanalyse. c) Testopsætning for kompressionskraftanalyse. d) Kraft vs. forskydning resultater fra bøjningstesten. e) Kraft vs. forskydning resultater fra kompressionstesten. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9
Mishra et al. observerede og kvantificerede dimensionerne af SMN-prækursorer og tilsvarende pyrolyserede CMN-strukturer ved hjælp af scanningselektronmikroskopi (SEM) billeder. Efter pyrolyse, diameteren og vægtykkelsen af mikronålen faldt. EDX-resultaterne viste øget atomprocent af kulstofelementer for kulstof-MN'er. Fraværet af nitrogen i kulstofmikronålens sammensætning indikerede dens fjernelse under opvarmning. Procentdelen af oxygenindholdet skyldtes CMN-strukturen og Si/SiO 2 underlagets overflade. Raman-spektroskopi viste den glasagtige krystallinske natur af den endelige mikrostruktur ved hjælp af verifikation af carbonproduktet. Resultaterne stemte overens med tidligere undersøgelser.
Forskerne opnåede lastforskydningsdata via nanoindentation for de separate SU-8- og kulstofstrukturer. De beregnede hårdheden og elasticitetsmodulet ved hjælp af Oliver Pharr-modellen. Resultaterne viste en hårdhed på 0,33 GPa og Youngs modul på 5,52 GPa for SMN. Ved konvertering til CMN via pyrolyse, fordybningsresultaterne viste højere elasticitet af materialet, hårdheden steg otte gange til 2,62 GPa og Youngs modul steg 4,8 gange til 26,97 GPa.
For at forstå MN'ers evne til at modstå kræfter uden at gå i stykker under indføring i huden, Mishra et al. udført bøjnings- og trykkraftmålinger af strukturen. Typisk, en MN oplever modstand under hudpenetration, den påførte kraft bør derfor være større end den modsatte kraft. For at teste bøjning/kompression, MN'erne blev indlæst i en Instron mikrotester, og en metalplade blev drevet mod MN'erne, indtil de gik i stykker; hvis den påførte belastning var under den maksimale tryk- eller bøjningskraft, nålene knækker ikke. Et kraftigt fald i trykkraften eller bøjningskraften indikerede et brudpunkt. Resultaterne viste, at CMN'er var meget stærkere end prækursorerne, giver dem mulighed for at overvinde modstand under hudpenetrering.
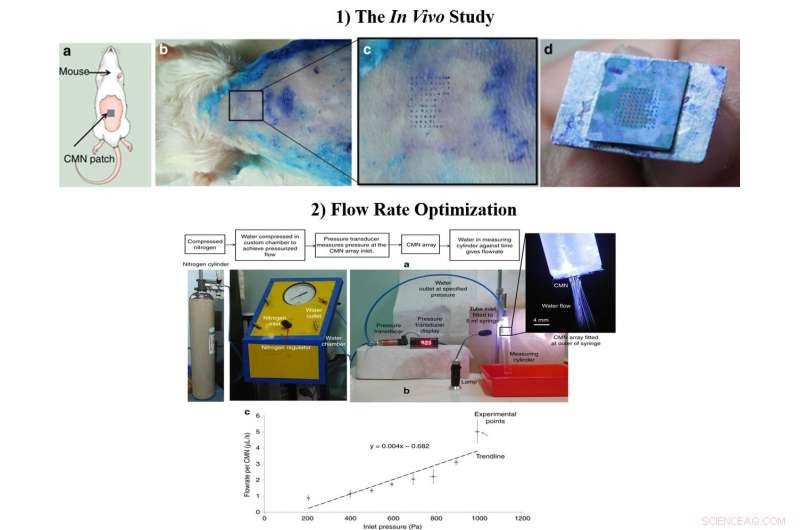
1) In vivo-undersøgelsen a) Skematisk af MN-indsættelsestesten på mus. b) Biologisk insertionstest udført på 6- til 8 uger gamle schweiziske albino-mus. c) Forstørret billede af hudområdet gennemboret af CMN'erne. d) Intakt array på 10 × 10 efter flere indsættelser. 2) Den optimerede strømningshastighed, a) Testopsætning til flowhastighedsmåling. b) Flowhastighed pr. mikronål ved forskellige indløbstryk. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0039-9
Efter at have bekræftet den mekaniske karakter og overlegenhed af hule CMN'er i laboratoriet, Richa Mishra og kolleger udførte in vivo-eksperimenter for at teste CMN'erne på musehud. En mikronåle-array frisk dyppet i methylenblåt blev presset på huden af en schweizisk albino-musemodel og langsomt trukket tilbage flere gange. Nålemærkerne af methylenblåt var synlige, MN'erne forblev intakte efter flere indsættelser, og en 500 µm arrayafstand var optimal til yderligere undersøgelser i laboratoriet.
Forskerne optimerede flowdimensioner under fremstillingsprocessen og inkluderede mikrofluidiske rør med reduceret størrelse for forbedret MN-funktionalitet. For at teste strømningshastighederne, de vedhæftede en 5-ml sprøjte med et tilpasset kammer indeholdende deioniseret vand. Da forskerne målte den gennemsnitlige strømningshastighed versus tryk for individuelle MN'er, resultaterne viste, at lægemiddellevering i sidste ende kunne kontrolleres ved at modificere indgangstrykket.
Den endelige materialekarakteriseringsteknik i undersøgelsen var nanoindentation, da parameteren kvantificerede overfladehårdhed og Youngs modul for at verificere overlegenheden af CMN'er. Fremtidigt arbejde vil omfatte udvikling af kontrolleret lægemiddellevering, med en mikropumpe og et lægemiddelreservoir integreret i MN-designet. På denne måde forskerne sigter mod at udvikle avancerede lægemiddel- og vaccineleveringssystemer i sundhedsvæsenet, der er omkostningseffektive, præcis og smertefri for patienten.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 2D nanomateriale MXene:Det perfekte smøremiddel til rovereAtomlagene kan bevæge sig i forhold til hinanden, reducere friktion. Kredit:Vienna University of Technology Du kan smøre en cykelkæde med olie, men hvad gør man med en Mars-rover eller et rødgløde
2D nanomateriale MXene:Det perfekte smøremiddel til rovereAtomlagene kan bevæge sig i forhold til hinanden, reducere friktion. Kredit:Vienna University of Technology Du kan smøre en cykelkæde med olie, men hvad gør man med en Mars-rover eller et rødgløde -
 Videnskabsmand opdager, hvordan bladfugle laver komplekse farveproducerende krystallerModhagespidser af hanlige blåvingede løvfugle, viser tilstedeværelsen af farveproducerende nanostrukturer. Kredit:Dr. Vinod Kumar Saranathan. En nylig undersøgelse foretaget af et team af forske
Videnskabsmand opdager, hvordan bladfugle laver komplekse farveproducerende krystallerModhagespidser af hanlige blåvingede løvfugle, viser tilstedeværelsen af farveproducerende nanostrukturer. Kredit:Dr. Vinod Kumar Saranathan. En nylig undersøgelse foretaget af et team af forske -
 Skalerbar fremstillingsproces spoler strimler af grafen ud til brug i ultratynde membranerEn ny fremstillingsproces producerer strimler af grafen, i stor skala, til brug i membranteknologier og andre applikationer. Kredit:Christine Daniloff, MIT MIT ingeniører har udviklet en kontinuer
Skalerbar fremstillingsproces spoler strimler af grafen ud til brug i ultratynde membranerEn ny fremstillingsproces producerer strimler af grafen, i stor skala, til brug i membranteknologier og andre applikationer. Kredit:Christine Daniloff, MIT MIT ingeniører har udviklet en kontinuer -
 I laboratorieundersøgelser, nanopartikler viser lovende resultater til behandling af alvorlige alle…Kredit:Pixabay/CC0 Public Domain For omkring et ud af 13 børn i USA, normalt harmløse fødevarer såsom mælk, æg og jordnødder kan sende kroppens naturlige forsvar i overdrev. Symptomer på fødevare
I laboratorieundersøgelser, nanopartikler viser lovende resultater til behandling af alvorlige alle…Kredit:Pixabay/CC0 Public Domain For omkring et ud af 13 børn i USA, normalt harmløse fødevarer såsom mælk, æg og jordnødder kan sende kroppens naturlige forsvar i overdrev. Symptomer på fødevare
- Forskere opdager de matematiske regler, der understøtter hjernevækst
- Nyt nanomateriale kan udvinde brintbrændstof fra havvand
- Unik undersøgelse tester grundlæggende fysiklove
- Duften af gamle bøger kunne hjælpe med at bevare dem
- Nyt værktøj kan hjælpe molekylærbiologer med at forstå komplekse processer i celler
- Californiske brandmænd jagter nye brande antændt af lyn


