DNA origami:Et præcist måleværktøj til optimal antistofeffektivitet

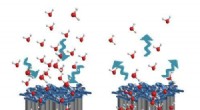
Ved at bruge DNA-origami, forskere har nu været i stand til præcist at måle afstandene mellem antigener, som antistoffer fortrinsvis binder til. Kredit:Björn Högberg
Forskere ved Karolinska Institutet, Sverige, i samarbejde med forskere ved Universitetet i Oslo, Norge, har påvist den mest nøjagtige afstand mellem tætpakkede antigener for at få den stærkeste binding til antistoffer i immunsystemet. Studiet, som er publiceret i tidsskriftet Natur nanoteknologi , kan have betydning for udviklingen af vacciner og immunterapi, der anvendes til cancer.
Vacciner virker ved at træne immunsystemet med harmløse blandinger af antigener (fremmede stoffer, der udløser en reaktion i immunsystemet), fra en virus, for eksempel. Når kroppen så udsættes for virussen, immunsystemet genkender de antigener, som virussen bærer på, og er i stand til effektivt at forhindre en infektion.
I dag, mange nye vacciner gør brug af noget, der kaldes "partikeldisplay, " hvilket betyder, at antigenerne indføres i kroppen og præsenteres for immunsystemet i form af partikler med masser af antigener tæt pakket på overfladen. I nogle tilfælde, partikelvisning af antigener fungerer bedre som en vaccine end blot at give frie antigener; et eksempel er HPV-vaccinen, som beskytter mod livmoderhalskræft.
Antistoffer, eller immunglobuliner, måske den vigtigste del af kroppens forsvar mod infektion, binder antigener meget effektivt. Antistofferne har en Y-formet struktur, hvorved hver "arm" kan binde et antigen. På denne måde hvert antistofmolekyle kan normalt binde to antigenmolekyler.
I den aktuelle undersøgelse, forskerne undersøgte, hvor tæt og hvor langt fra hinanden antigenerne kan pakkes uden at påvirke et antistofs evne til at binde begge molekyler samtidigt.
"Vi har for første gang været i stand til præcist at måle afstandene mellem antigener, der resulterer i den bedste samtidige binding af begge arme af forskellige antistoffer. Afstande på cirka 16 nanometer giver den stærkeste binding, siger Björn Högberg, professor ved Institut for Medicinsk Biokemi og Biofysik, Karolinska Institutet, der ledede undersøgelsen.
Undersøgelsen viser også, at immunoglobulin M (IgM), det første antistof involveret i en infektion, er betydeligt større rækkevidde, det er evnen til at binde to antigener, end tidligere antaget. IgM har også en væsentlig større rækkevidde end de IgG-antistoffer, der produceres på et senere tidspunkt af en infektion.
Teknologien, som forskerne brugte, er baseret på en relativt ny teknik kendt som DNA-origami, som har været i brug siden 2006, der gør det muligt at designe præcise nanostrukturer ved hjælp af DNA. Imidlertid, det er først i de senere år, at videnskabsmænd har lært at bruge denne teknik i biologisk forskning. Applikationen brugt i undersøgelsen er nyudviklet.
"Ved at sætte antigener på disse DNA origami strukturer, vi kan fremstille overflader med præcise afstande mellem antigenerne og så måle, hvordan forskellige typer antistoffer binder til dem. Nu kan vi måle præcis, hvordan antistoffer interagerer med flere antigener på en måde, som tidligere var umulig, " siger Björn Högberg.
Resultaterne kan bruges til bedre at forstå immunresponset, for eksempel hvorfor B-lymfocytter, en type hvide blodlegemer, aktiveres så effektivt af partikeldisplayvacciner, og at designe bedre antistoffer til immunterapi ved behandling af kræft.
Forskningen er udført i tæt samarbejde med Laboratory of adaptive immunity and homeostase ledet af Jan Terje Anderson, ved Universitetet i Oslo og Oslo Universitetshospital.
"Vi studerer sammenhængen mellem antistoffers struktur og funktion. En sådan indsigt er vigtig, når vi designer næste generation af vacciner og antistoffer til skræddersyet behandling af alvorlige sygdomme. Vi har længe ledt efter nye metoder, der kan hjælpe os med at blive detaljeret indsigt i, hvordan forskellige antistoffer binder sig til antigenerne.Samarbejdet med Björn Högberg har åbnet helt nye døre, siger Jan Terje Andersen.
 Varme artikler
Varme artikler
-
 Ny metode til at forbedre termisk ledningsevne kunne afkøle computerchips, lasere og andre enhederDette er et par bor -nanoribbons, der sidder sammen på en mikrodelen, der bruges til at måle varmeledningsevne. Kredit:Deyu Li Den overraskende opdagelse af en ny måde at tune og forbedre termisk
Ny metode til at forbedre termisk ledningsevne kunne afkøle computerchips, lasere og andre enhederDette er et par bor -nanoribbons, der sidder sammen på en mikrodelen, der bruges til at måle varmeledningsevne. Kredit:Deyu Li Den overraskende opdagelse af en ny måde at tune og forbedre termisk -
 Forskningsgruppe skaber meget følsom fotodetektor fra grafen og kvantepunkterHybrid grafen-kvantepunktfototransistor. Billede (c) Naturnanoteknologi (2012) doi:10.1038/nnano.2012.60 (Phys.org) - Det er lykkedes forskere i Spanien at opbygge en fotodetektor, der er en mil
Forskningsgruppe skaber meget følsom fotodetektor fra grafen og kvantepunkterHybrid grafen-kvantepunktfototransistor. Billede (c) Naturnanoteknologi (2012) doi:10.1038/nnano.2012.60 (Phys.org) - Det er lykkedes forskere i Spanien at opbygge en fotodetektor, der er en mil -
 Transparente solceller til vinduer, der genererer strømForskere rapporterer udvikling af en ny gennemsigtig solcelle, et fremskridt i retning af at give vinduer i boliger og andre bygninger mulighed for at generere elektricitet, samtidig med at folk kan s
Transparente solceller til vinduer, der genererer strømForskere rapporterer udvikling af en ny gennemsigtig solcelle, et fremskridt i retning af at give vinduer i boliger og andre bygninger mulighed for at generere elektricitet, samtidig med at folk kan s -
 Nanorørskove drikker vand fra tør luftEt hygroskopisk stillads skabt ved Rice University er en modificeret skov af kulnanorør, der har mulighed for at høste vandmolekyler fra luften. Vandet opbevares, indtil det frigives enten ved at klem
Nanorørskove drikker vand fra tør luftEt hygroskopisk stillads skabt ved Rice University er en modificeret skov af kulnanorør, der har mulighed for at høste vandmolekyler fra luften. Vandet opbevares, indtil det frigives enten ved at klem
- Forskere låser op for en hemmelig vej til en kvantefremtid
- Hvorfor er planter grønne? Forskningsteams model gengiver fotosyntese
- En inkjet-printet felt-effekt-transistor til etiketfri biosensering
- Løntyveri er blevet en kulturelt accepteret del af erhvervslivet
- Amazon bevarer det bedste brands omdømme, Apple og Google reps dukkert
- Alsidig sensor mod tumorinitierende celler


