Therapeutics-on-a-chip (TOC):Fremstilling af syntetiske proteiner til point-of-care-terapi
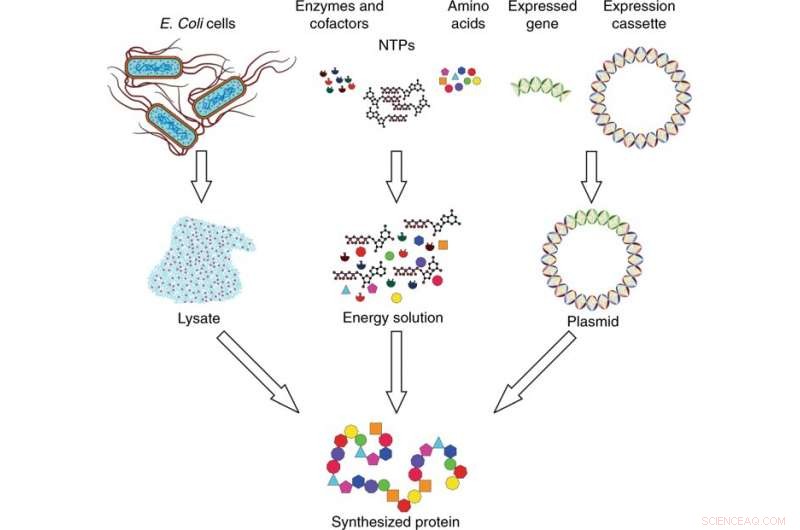
Oversigt over cellefrit proteinsyntesesystem. Syntesesystemet består af tre komponenter:lysat, energiløsning, og plasmid-DNA. Lysatet opsamles fra E. coli-celler ved cellelyse og fremstilles ved hjælp af ultracentrifugering. Energiopløsningen er sammensat af nukleosidtrifosfater (NTP'er), aminosyrer, enzymer, og cofaktorer. Plasmid-DNA'et fremstilles ved at indsætte det udtrykte gen af interesse i en ekspressionskassette. De tre komponenter kombineres og inkuberes for at syntetisere protein af interesse. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8
Terapeutiske proteiner er proteinbaserede lægemiddelkandidater, der er biokonstrueret i laboratoriet til farmaceutiske og kliniske anvendelser. Baseret på deres farmakokinetik, kandidaterne kan opdeles i grupper, der (1) erstatter et defekt eller unormalt protein, (2) udvide en eksisterende sti in vivo, (3) levere en ny funktion eller aktivitet in vivo, (4) forstyrre aktiviteter i et molekyle eller en organisme og (5) levere indkapslede proteiner eller forbindelser, herunder, cellegift, radionuklid- eller effektorproteiner.
I en nylig undersøgelse offentliggjort i Mikrosystemer og nanoteknik , Travis W. Murphy og kolleger ved afdelingerne for kemisk og biologisk systemteknik ved Virginia Tech udviklede en omkostningseffektiv, point-of-care syntetisk og oprensningsplatform til protein engineering. De byggede en integreret mikrofluidik "Therapeutics-on-a-Chip (TOC)" enhed til cellefri, terapeutisk proteinsyntese og terapeutisk proteinoprensning i en enkelt opsætning.
Evnen til at syntetisere terapeutiske proteiner i et point-of-care miljø, kan hurtigt reducere omkostningerne til opbevaring og transport under global distribution i ressourcefattige regioner og bidrage til begrebet sparsommelig videnskab. Et flertal af proteiner produceres i øjeblikket ved hjælp af cellekultursystemer såsom den rekombinante Escherichia coli, gær, pattedyrceller og planteceller til fremstilling i stor skala, hvorefter de distribueres globalt fra centraliserede støberier. Imidlertid, den begrænsede halveringstid af disse syntetiske proteiner kræver lager- og forsendelsesfaciliteter ved lav temperatur, som er udfordrende for patienter, der bor i fjerntliggende områder og områder med lav ressource.
I nærværende arbejde, Murphy et al. demonstrerede først anordningens arbejdsprincipper ved at udtrykke og oprense et reporterprotein - grønt fluorescerende protein. Efterfulgt af brugen af TOC til at producere cecropin B – et antimikrobielt peptid, der i vid udstrækning anvendes til at kontrollere biofilmsygdomme. Forskerne syntetiserede og rensede med succes cecropin B for at producere en koncentration på 63 ng/µL på seks timer, med en renhed på 92 procent, efterfulgt af bekræftelse af dets antimikrobielle egenskaber med et vækstinhiberingsassay. TOC-teknologien giver en ny platform for point-of-care proteinsyntese og oprensning til tilgængelige kliniske terapier.
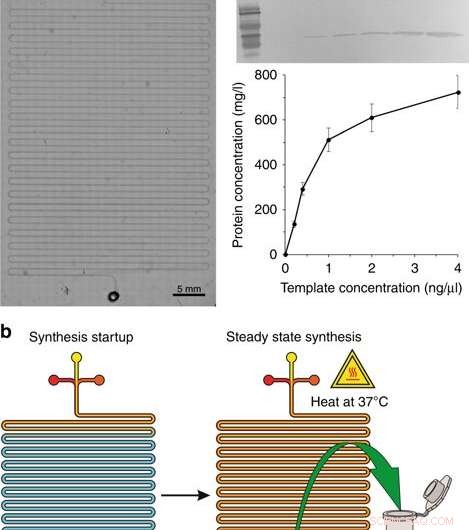
a) Et mikroskopisk billede af syntesemodulet. b) Trinene til syntese:start af syntese og steady state syntese. c Western blotting af GFP produceret i CFPS-systemet og proteinudbyttet med forskellige koncentrationer af plasmidskabelonen. Mus 6 × His-tag monoklonalt primært antistof og HRP-konjugeret gede-anti-muse IgG (H + L) sekundært antistof blev brugt til at påvise målproteinet. De anførte koncentrationer er koncentrationerne i det endelige reaktionsvolumen. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8
De state-of-the-art anordninger, der i øjeblikket er i brug til brug ved proteinsyntese, omfatter et køleskabsstørrelsessystem, der strækker sig over en to-dages produktionsrensningscyklus til fremstilling af 800 doser af et lægemiddel pr. Dag. Alligevel er kapitalomkostningerne forbundet med et sådant system ikke gennemførlige i udviklingslandene, hvor behovet for hurtig produktion af masseterapi til distribution opvejer masseterapeutisk produktion til langtidsopbevaring. I TOC-systemet udviklet af Murphy et al. forskerne gennemførte point-of-care syntese og oprensning af terapeutiske proteiner ved hjælp af en cellefri proteinsyntese (CFPS) proces. I dette system, rekombinante proteiner blev udtrykt uden brug af levende celler, velegnet til point-of-care produktion, hvor frysetørrede udgangsmaterialer kunne forblive stabile under opbevaring over et bredt temperaturområde.
Blandt de proteiner, der blev undersøgt i undersøgelsen, cecropin B har en minimumshæmmende koncentration på 9,5 ng/µL for at udøve antimikrobielle virkninger. Ved hjælp af mikrofluidisk opsætning, forskerne kombinerede proteinsyntese og oprensning for at producere et antimikrobielt peptid cecropin B i en klinisk relevant dosis (63 ng/µL). Den kontinuerlige produktion i opsætningen blev afsluttet i tre udviklingsfaser:
- Cellefri proteinsyntese (CFPS) reaktordesign
- Rensningsreaktor (P) design
- Integreret CFPS+P systemdesign
Murphy et al. brugt soft-litografi baseret polydimethylsiloxan (PMDS) støbning til at fremstille enhederne; opbygning af flerlag ved hjælp af mikromekaniske ventiler.
Under den første fase af enhedsdesign i CFPS-reaktoren, forskerne fremstillede en slangekanal mikrofluidisk chip, svarende til tidligere undersøgelser for on-chip proteinsyntese. Den mikrofluidiske enhed indeholdt indløb forbundet til en sprøjtepumpe placeret på varmetrinnet i et mikroskop, hvor tre indløb modtog (1) cellelysat, (2) CFPS-reaktionsbuffer og en (3) DNA-skabelon ind i den lange serpentinkanal (ca. 130 cm) med ét udløb. Forskerne fodrede de tre reaktionskomponenter med en kombineret strømningshastighed på 0,15 µL/min drevet af en sprøjtepumpe i en opholdstid på 1,5 time. De opvarmede reaktoren med en trinvarmer (37 grader C) og modellerede opsætningen ved hjælp af COMSOL Multiphysics-software til at verificere enhedens mekanik, for optimal diffusionsbaseret blanding og reaktion på chip. For at validere enhedens driftsprincipper, Murphy et al. syntetiserede reporterproteinet, GFP ved hjælp af en række forskellige DNA -skabeloner. Systemet producerede mængder af protein ved en konstant reaktionstid.
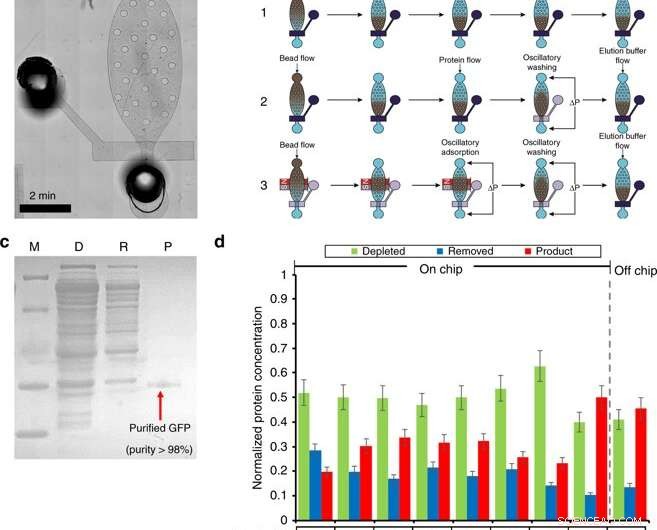
Proteinrensning i et mikrofluidkammer. a) Et mikroskopisk billede af oprensningsmodulet. b) Oversigt over oprensningsproceduren (inklusive perlefyldning, sengedannelse, proteinadsorption, vask, og eluering) af tre forskellige arbejdsgange. Workflow 1 bruger flowadsorption og vasketrin. Workflow 2 anvender flowadsorption og oscillerende vask. Workflow 3 bruger oscillerende adsorption og vask. Mørkeblå betegner en lukket ventil, hvor gennemsigtighed angiver en åben ventil. c) SDS-PAGE af GFP oprenset af oprensningschippen. M (Markør); D (Depleteret):CFPS-reaktionsblanding efter perleabsorption; R (fjernet):fjernede forureninger i oprensningsbufferen; P (Produkt):oprenset GFP i elueringsbufferen. d) Oprensningstrin-optimeringen. Optimering blev udført ved at undersøge 4 betingelser. (1) Ni-NTA perlevolumen på 5 eller 8 µl; (2) 0,5 % Tween-20 tilsat til oprensnings- og elueringsbuffere. (3) Forskellige arbejdsgange. (4) Forskellige oscillerende adsorptionstider. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8
I anden fase, Murphy et al. designet en mikrofluidisk enhed til proteinrensning baseret på en højeffektiv adsorptions- og vaskeprotokol, som demonstreret af det samme forskerhold tidligere. De betjente enheden ved hjælp af magnetventiler til at styre den enkelte mikromekaniske ventil og tilhørende oscillerende trykimpulser for at udføre proteinrensning i fire store trin.
I arbejdsgangen, trin var (1) perleladning, (2) proteinadsorption, (3) vask og (4) eluering. For at optimere processen, forskerne opdelte metoden til tre forskellige arbejdsgange. Murphy et al. derefter varierede betingelserne, der påvirker resultaterne af proteinrensning, for at opnå produktrenhed så høj som 98,5 procent, med et udbytte på 54,6 procent af produktet, bedre end andre metoder.
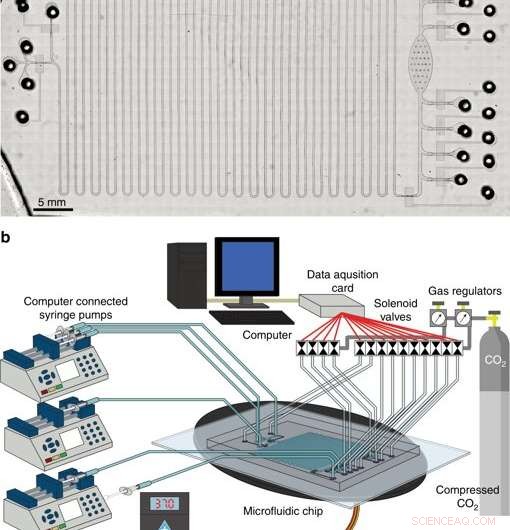
Det integrerede system til cellefri proteinsyntese og oprensning. et mikrofotografi af integreret CFPS + P platform. b Oversigt over integreret CFPS+P platformopsætning. Systemet består af computerstyrede magnetventiler og sprøjtepumper, der er tilsluttet en mikrofluid-enhed placeret på et varmestadium. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8.
I fase tre, forskerne udviklede en integreret mikrofluidisk platform med cellefri proteinsyntese og oprensning (CFPS+P) til automatisering. De kombinerede en kontinuerlig strømningsreaktor og en batchrensningsanordning, selvom de to processer ikke var iboende kompatible med hinanden til at begynde med. For at opnå tilstrækkelig kompatibilitet, de forbinder de to processer ved hjælp af et rørreservoir, der opbevarede det kontinuerligt producerede protein på en chip, før oprensning. Alt apparatur brugt i undersøgelsen til at betjene mikrofluidsystemet kunne potentielt passe til størrelsen af en dokumentmappe, gør den meget bærbar, terapeutisk proteinproduktionssystem.
I alt, den fuldt integrerede CFPS+P-chip indeholdt fem store trin, herunder, priming, proteinsyntese, proteinadsorption, vask og eluering. I et sjette trin, forskerne arrangerede perleforfriskende. Murphy et al. brugte serpentinsyntesekanalen som det individuelle syntesemodul, efter at de syntetiserede den ønskede mængde protein, de lukkede opsætningen fra rensningsmodulet for at starte den efterfølgende rensningsproces. For at teste arbejdsgangen for opsætningen, forskerne brugte GFP og opnåede en renhed på 98 procent.
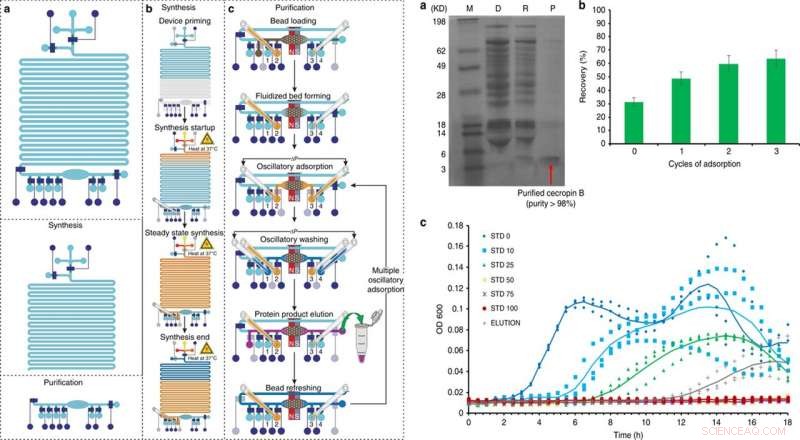
VENSTRE:Oversigt og drift af den integrerede cellefrie proteinsyntese- og oprensningsplatform i 5 store trin:a) priming, b) proteinsyntese, c) proteinadsorption, vask, og eluering, med et valgfrit 6. trin af perleopfriskning. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8. TIL HØJRE:Cecropin B syntese og oprensning ved hjælp af integreret CFPS + P mikrofluidisk enhed. a) Tricin-PAGE af cecropin B syntetiseret og oprenset af den integrerede chip. M (markør); D (depleteret):CFPS-reaktionsblanding efter perleabsorption; R (fjernet):fjernet kontaminater i oprensningsbufferen; P (produkt):oprenset AMP i elueringsbufferen. b) Optimering af genvinding af cecropin B ved brug af flere adsorptionscyklusser. c) Væksthæmningsassays af E. coli udført i tre eksemplarer, brug af proteinproduktet (eluering) efter tre adsorptions-/elueringscyklusser ved vores enhed i sammenligning med cecropin B -standarder for forskellige koncentrationer (0-100 ng/μl, betegnet som STD 0-100). OD600 blev målt hvert 30. minut i 18 timer. Eluering med en koncentration på 27 ng/μl i 60 μl opløsning blev anvendt. Trendlinjer, der repræsenterer gennemsnittet af tre forsøg, tilføjes for at guide øjet. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8.
Efter CFPS+P workflowoptimering ved hjælp af GFP, videnskabsmændene brugte det samme setup til at optimere betingelserne for at syntetisere cecropin B. Ved at følge trinene i udtryk, rensning, elektroforese og farvning i opsætningen, Murphy et al. bekræftede den vellykkede produktion og oprensning af cecropin B og genvundne opløselige proteiner til eluering af 63 ng/µL, med en renhed på 92 procent. De testede derefter bioaktiviteten af cecropin B i forhold til E coli hæmning for at demonstrere vellykket antibiotisk aktivitet ved at hæmme bakterievækst.
På denne måde terapeutiske proteiner syntetiseret og oprenset ved hjælp af den mikrofluidiske opsætning viste aktiv og effektiv undertrykkelse af bakteriel vækst. Det omkostningseffektive system kan aktivt integreres i miljøer med lave ressourcer til sparsommelig videnskab. Murphy et al. agter at fuldstændig automatisere systemet baseret på løbende optimeringer i fremtiden. De forestiller sig anvendelser af opsætningen til at konstruere en række forskellige terapeutiske proteiner til omkostningseffektiv point-of-care produktion.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Opløsning af DNA og guld nanorods i stand til seks grundlæggende logiske operationerGuld nanorods belagt med dsDNA fungerer som en OR logisk gate i nærvær af østrogenreceptorproteinerne ERα og ERβ. Kredit:A*STAR Institute of Materials Research and Engineering Ved at tilføje DNA-s
Opløsning af DNA og guld nanorods i stand til seks grundlæggende logiske operationerGuld nanorods belagt med dsDNA fungerer som en OR logisk gate i nærvær af østrogenreceptorproteinerne ERα og ERβ. Kredit:A*STAR Institute of Materials Research and Engineering Ved at tilføje DNA-s -
 Nanoteknologi forbedrer leveringen af kemoterapiMichigan State Universitys Bryan Smith har opfundet en ny måde at overvåge kemoterapikoncentrationer, hvilket er mere effektivt til at holde patienters behandlinger inden for det afgørende terapeutisk
Nanoteknologi forbedrer leveringen af kemoterapiMichigan State Universitys Bryan Smith har opfundet en ny måde at overvåge kemoterapikoncentrationer, hvilket er mere effektivt til at holde patienters behandlinger inden for det afgørende terapeutisk -
 Hybridmateriale som bladguld erstatningHybridfilmen på et filter (r.a.) og på glas (ETH-logo). REM afslører mikro (øverst til venstre) og nano (nederst til venstre) strukturen af dette særlige materiale. Kredit:Li, C., Adv. Mater. 2013
Hybridmateriale som bladguld erstatningHybridfilmen på et filter (r.a.) og på glas (ETH-logo). REM afslører mikro (øverst til venstre) og nano (nederst til venstre) strukturen af dette særlige materiale. Kredit:Li, C., Adv. Mater. 2013 -
 Forskere udvikler interessante byggesten til kvantecomputereKredit:CC0 Public Domain Forskere ved MESA+ forskningsinstitut ved University of Twente, arbejder sammen med kolleger i Delft og Eindhoven, har med succes udviklet nanotråde, der tillader individu
Forskere udvikler interessante byggesten til kvantecomputereKredit:CC0 Public Domain Forskere ved MESA+ forskningsinstitut ved University of Twente, arbejder sammen med kolleger i Delft og Eindhoven, har med succes udviklet nanotråde, der tillader individu
- Forskelle mellem Minks & Weasels
- Havsygt:Plastaffald i det nordlige Atlanterhav skyder i vejret
- Hvornår kan du se Venus i fuld fase?
- At bringe billigere, grønnere belysning til markedet med inkjet-printede hybrid-quantum dot-lysdiod…
- 40 procent af Oahu, Hawaii strande kan være tabt i midten af århundredet
- Matematiker opdager metode til at forenkle polymervækstmodellering


