Skydevægge – et nyt paradigme for mikrofluidiske enheder
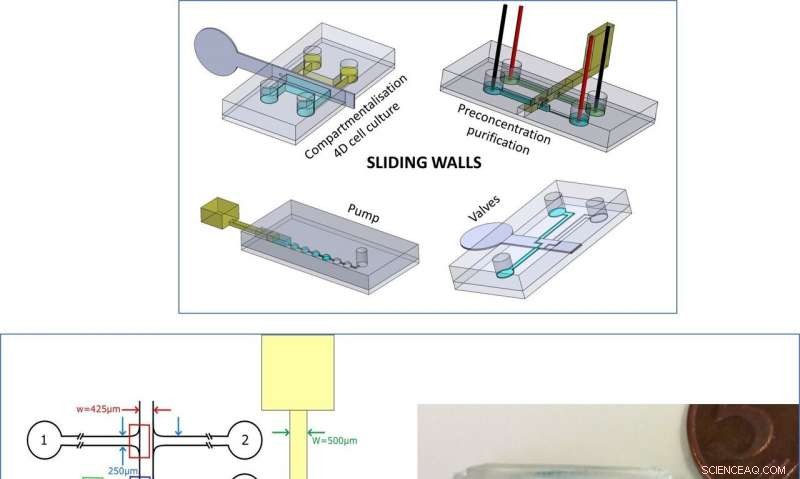
Øverst:Resumé af den nye teknologi. Til venstre:Design af mikrochip og glidevæg til DNA prækoncentration. Til højre:Billede af mikrochippen og skydevæg til opdelingsforsøg. Blå og gule farvestoffer er blevet tilføjet til visualisering. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
Et forskerhold udviklede for nylig "skydevægge" som en ny teknik til væskekontrol i mikrofluidiske enheder, tillader halvstive eller stive vægge at glide inde i en mikrofluidisk chip. I en ny rapport nu på Natur:Mikrosystemer og nanoteknik , Bastien Venzac og et team af forskere ved Institute Curie og Sorbonne University i Paris, Frankrig, konstrueret flere fluidiske funktioner ved hjælp af glidende væggeometri. Enheden indeholdt tænd/sluk-kontaktventiler til at blokere eller omkonfigurere kanaler afhængigt af væggeometrien. Opsætningen indeholdt en hydrogel-baseret membran til at koncentrere, rense og transportere biomolekyler fra en kanal til en anden. Teknikken er kompatibel med bløde litografimetoder for nem implementering baseret på typiske fremstillingsarbejdsgange på polydimethylsiloxan (PDMS) chips. Den nye metode åbner en vej til en række mikrofluidapplikationer, danner enkel, hånddrevne enheder til point-of-care applikationer i biologiske laboratorier.
Virkelig rekonfigurerbare systemer er en mikrofluidikingeniørs drøm, hvor remodeling beskriver smarte systemer bygget i modulære enheder og samlet til hurtig omorganisering mellem eksperimenter. For de fleste mikrofluidiske systemer, imidlertid, kanalnetværket forbliver fast under mikrofremstilling og kan ikke tilpasses omstruktureres under eksperimentet. Ingeniører er også kun i stand til at udføre ændringer i pumpning, ventilering eller brug af eksterne kræfter af elektricitet og magnetiske felter. For at imødekomme de eksisterende grænser eller udfordringer for mikrofluidproduktion, Venzac et al. foreslået et nyt koncept for mikrofluidisk aktivering kendt som "skydevægge". Metoden er kompatibel med fremstilling af blød litografi, men kræver ikke eksternt udstyr. Den kan betjenes manuelt og kan indgå i en enkelt enhedskomponent.
Venzac et al. udviklet glidevægge ved hjælp af adskillige fremstillingsmetoder til at konstruere dem inde i åbne kanaler af polydimethylsiloxan (PDMS) chips. Aktiveringsprocessen gav dem mulighed for reversibelt at åbne eller lukke en kanal, der pumpede væsker, reorientere derefter strømme for at omkonfigurere et mikrofluidisk netværk efter behag. Holdet beskrev metodens princip og demonstrerede enkle funktioner, herunder dannelse af en hydrogelplade til at rumme firedimensionelle (4-D), kontrolleret cellekultur, efterfulgt af membranbaseret elektrokinetisk DNA-prækoncentration i mikrofluidrum. De implementerede teknologien til lave omkostninger for hurtig prototyping og manuelt styrede glidevæggene for enkelhedens skyld, holdet kunne også fuldautomatisere væggene ved hjælp af computerstyrede motorer eller aktuatorer. Den nye værktøjskasse er velegnet til applikationer med mikrofluidkanaldimensioner over 100 µm og kræver kun få aktiveringselementer.
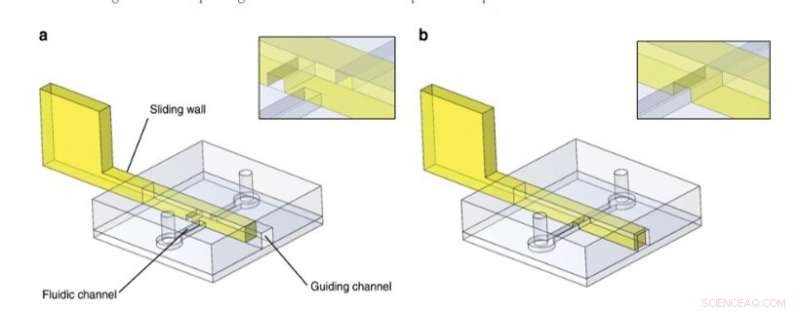
Skydevægsprincip. PDMS-strukturer indeholder en ledekanal og en fluidkanal og blev bundet til en plan PDMS-overflade. I dette eksempel, en glidevæg med en indgraveret kanal blev indsat efter spånfremstilling inde i føringskanalen. Fluidkanalen var a blokeret eller b fri. Detaljer om skæringspunktet mellem glidevæg og væskekanal findes i indsatserne. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
For det generelle designprincip, forskerne indsatte en stiv/halvstiv struktur i en styrekanal i PDMS-mikrofluidchippen og brugte en række forskellige materialer til at udvikle glidevægge, herunder (1) film af rustfrit stål, (2) fotohærdbar resist fotopolymeriseret i PDMS-forme, og (3) fotohærdende harpiks støbt under anvendelse af stereolitografisk 3-D-print. De valgte de tekniske teknikker til at passe til eksperimentet i overensstemmelse med deres iboende egenskaber og forhindrede, at væggen knækkede eller knækkede under aktivering ved at kontrollere materialets stivhed og foretrækker rustfrit stål til de fleste tynde glidende vægge. Til større glidende vægge brugte de konventionel stereolitografi og brugte mikrofræsning på rustfrit stål for at inkludere små detaljer på en glidende væg.
Som et indledende proof-of-concept, Venzac et al. forberedt to typer ventiler:en on/off ventil og en metallisk omskifterventil med en indgang og to udgange. Skydeventilerne er hovedsageligt interessante på grund af deres praktiske anvendelighed i organ-på-chip-enheder og cellekulturkonstruktioner. Forskerne viste også brugen af glidende vægge som on-chip sprøjter til manuelt at pumpe væsker og observerede ikke væskelækage under tryk eller aspiration af luft i eksperimenterne. Skydevæggene var opfindsomme til store kammerkonstruktioner - holdet tilføjede to smalle riller på kammertaget og gulvet for at styre en lodret glidevæg af rustfrit stål og regulere kommunikationen mellem rummene.
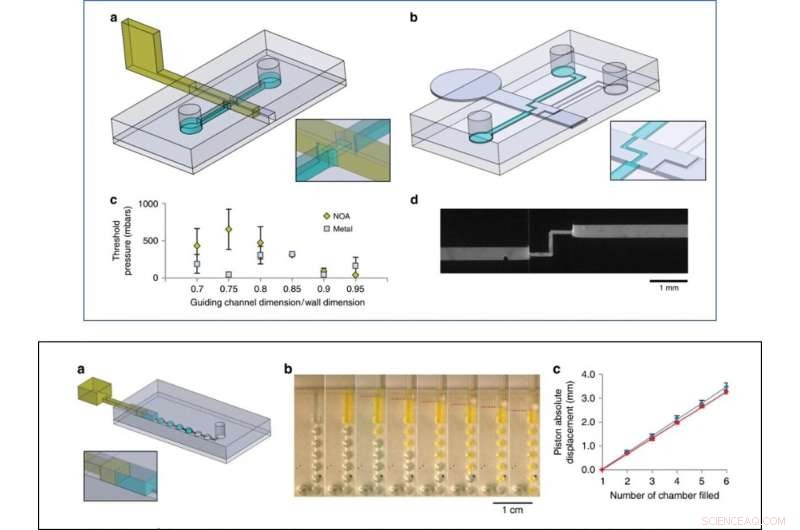
TOP:Ventileksperimenter. a Design af chip og fotohærdbar resist-baseret glidevæg til on-off ventil eksperimentet. b Design af chippen og den metalliske glidevæg til omskifterventilforsøget. c Maksimalt tryk, der modstås af resistbaserede (gule serier) og metalbaserede vægge (grå serier) for forskellige forhold mellem styrekanalen og glidevægshøjder og -bredder (tre forsøg pr. tilstand). d Fluorescerende billede af omskifterventilen med fluoresceinfyldt vand, der strømmer gennem den åbne vej (13 µl/s). NEDERST:Pumpeeksperiment. et chip design, b Sekventielle billeder af pumpning af fluoresceinfyldt vand gennem 1 µl kamre. Stemplets position er angivet med stiplede røde linjer. c Væskeforskydning versus absolut stempelforskydning (stempeloprindelse blev indstillet ved begyndelsen af fyldningen af det første kammer), for at skubbe (blå) og derefter trække (rød), gennemsnit over fire forskellige enheder. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
Holdet gennemførte i sidste ende biofunktionaliseringstests ved hjælp af den nye enhed og observerede 4-D cellekultur og cellemigration. I dette eksperiment, de fyldte en fluorescerende kollagenopløsning i højre halvdel af kammeret, fyldte den anden halvdel med buffer og blandede de to for at skabe en hydrogelplade. Sådanne hydrogeler er et væsentligt krav for at udvikle 3-D organ-på-chip rum. For at teste deres biologiske funktion, Venzac et al. studerede cellemigration med dendritiske celler (immunceller) indlæst i kollagenopløsningen inde i et kammer. Holdet fyldte det andet rum med en kemokinopløsning og fjernede glidevæggen i rustfrit stål for at skabe en lige grænseflade, der tillod kemoattraktanten at diffundere ud på kollagenpladen, så de dendritiske celler kan migrere på gel/opløsningsgrænsefladen, danner en 4-D cellekultur.
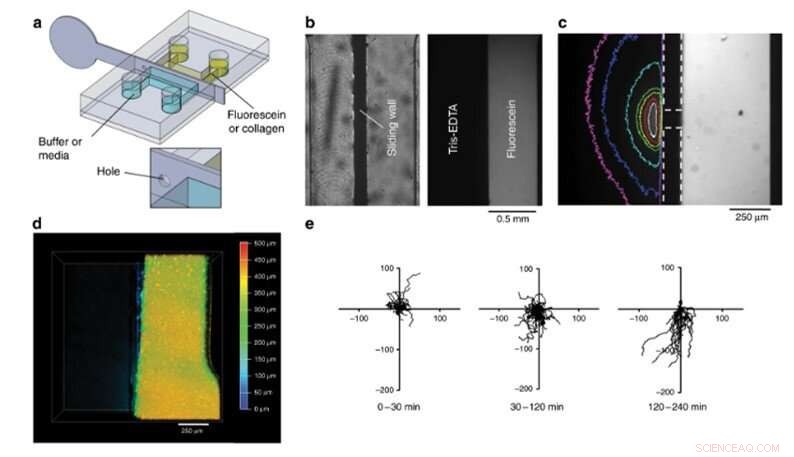
Opdelingsforsøg. (a) Design af spån og metallisk glidevæg. (b) Top-view billeder af en tætningstest. Til venstre:lyst billede af kammeret. Til højre:Fluorescerende billede af kammeret efter 8 h. (c) Gradient af fluorescein i Tris-EDTA-bufferrummet efter placering af et 200 µm hul i glidevæggen inde i kammeret. Grænser for skydevæg og hul er angivet med de stiplede linjer. Farvelinjerne svarer til billedoverfladen med en intensitet højere end 12 % af den maksimale værdi (hvid:1 s, rød:4 s, gul:9 s, grøn:14 s, cyan:50 s, blå:110 s, magenta:170 s efter vægforskydning). (d) Set ovenfra, dybdekodet konfokalt billede af en fluorescerende, geleret kollagenplade i højre, halv bund af kammeret efter fjernelse af glidevæggen. (e) Baner af dendritiske celler inde i kollagenpladen før fjernelse af glidende væg (0–30 min) og efter glidende vægfjernelse (30–240 min) nedbrydes i to perioder. Den første viste ingen foretrukken migration (30-120 min), mens celler tiltrækkes af kemokinrummet fra 120 til 240 minutter. Akserne er i mikrometer, og den lodrette akse peger væk fra kemokinrummet. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
De har også elektrokinetisk prækoncentrerede DNA-makromolekyler, kontrollerede deres transport og frigivelse i det nye setup. For at opnå dette, holdet brugte en bevægelig og rekonfigurerbar hydrogelmembran i mikrofluidsystemerne og konstruerede en glidende væg med et integreret vindue ved hjælp af højopløsnings 3-D-print. De påførte et konstant elektrisk felt i kanalerne for at tillade elektroforetisk migration af DNA-mærket med et fluorescerende mærke i bufferopløsning. Størrelsen af hydrogelporerne forhindrede DNA-migrering, får dem til at prækoncentrere sig ved membranen. Forskerne inducerede fri flow af prækoncentreret DNA i opsætningen, at transportere prøver fra en kanal til en anden, som en ny og enkel vej til prøveforberedelse og analyse.
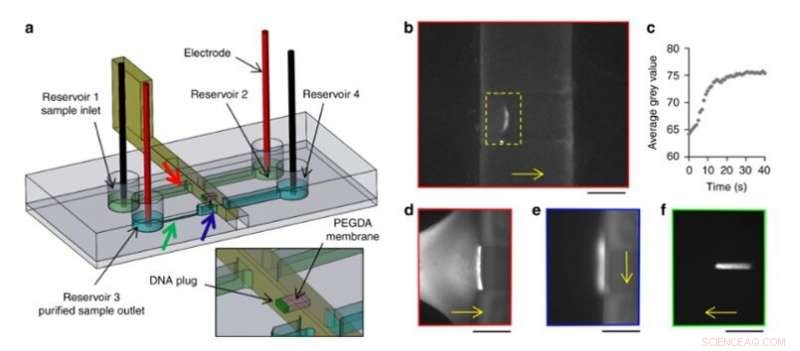
DNA prækoncentration og oprensningseksperiment. (a) Design af spånen og glidevæggen. En PEGDA-membran (lyserød) blev fotopolymeriseret i vinduet på en glidende væg. Farvede pile angiver placeringen af de følgende billeder med den tilsvarende farvede kant. (b) Prækoncentration ved elektroforese af 100 pg Lambda-DNA mod PEGDA-membranen i en 3D-printet glidevæg. (c) Udvikling over tid af den gennemsnitlige grå værdi inde i det gule rektangel i b). (d) Fluorescerende billeder af DNA under prækoncentration mod PEGDA-membranen, (e) efter forskydning til den anden kanal og (f) elektroforetisk frigivelse. Skala søjler:250 µm. DNA-migrerings- eller forskydningsretninger er angivet med de gule pile. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
På denne måde Bastien Venzac og kolleger udviklede en ny værktøjskasse til at innovere brugen af konventionel mikrofluidik. Skydevæggene havde yderligere funktioner såsom mikrokanaler eller vinduer med fyldte geler og løsninger til potentielle anvendelser ud over konventionelle in-chip ventiler. Især de opnåede 4-D cellekultur og DNA-prækoncentration ved hjælp af opsætningen med enkelt glidende væg. Forskerne forestiller sig teknikken i brede applikationer til billige og lavteknologiske biomedicinske miljøer.
© 2020 Science X Network
Sidste artikelHigh-throughput opdagelse af 2-D magneter
Næste artikelGrafenbaseret aktuatorsværm muliggør programmerbar deformation
 Varme artikler
Varme artikler
-
 Selvsamlende nanorods:Forskere opnår 1-, 2- og 3-D nanorod-arrays og netværkDette transmissionselektronmikrofotografi (a) viser cadmiumsulfid nanorods, der danner arrays, der er justeret og orienteret parallelt med de cylindriske mikrodomæner af blokcopolymerer. Den skematisk
Selvsamlende nanorods:Forskere opnår 1-, 2- og 3-D nanorod-arrays og netværkDette transmissionselektronmikrofotografi (a) viser cadmiumsulfid nanorods, der danner arrays, der er justeret og orienteret parallelt med de cylindriske mikrodomæner af blokcopolymerer. Den skematisk -
 Hybridbånd en gave til kraftige batterier:Vanadiumoxid - grafenmateriale fungerer godt til lithium-…Grafenbelagte bånd af vanadiumoxid, set i et scanningselektronmikroskopbillede, kan være den bedste elektrode til lithium-ion-batterier, der endnu er testet, ifølge forskere ved Rice University. Kredi
Hybridbånd en gave til kraftige batterier:Vanadiumoxid - grafenmateriale fungerer godt til lithium-…Grafenbelagte bånd af vanadiumoxid, set i et scanningselektronmikroskopbillede, kan være den bedste elektrode til lithium-ion-batterier, der endnu er testet, ifølge forskere ved Rice University. Kredi -
 Forskere skaber resonator med nanoskalafunktioner til at opdage farlige kemikalier i miljøetVakhtang Putkaradze og Arindam Phani (siddende), sammen med Thomas Thundat, har skabt en resonator med funktioner på nanoskala til at detektere farlige kemikalier i miljøet. Kredit:University of Alber
Forskere skaber resonator med nanoskalafunktioner til at opdage farlige kemikalier i miljøetVakhtang Putkaradze og Arindam Phani (siddende), sammen med Thomas Thundat, har skabt en resonator med funktioner på nanoskala til at detektere farlige kemikalier i miljøet. Kredit:University of Alber -
 Drejning af cd'er for at rense spildevandDette billede viser en optisk disk, der er fuldstændig belagt med nanoroder af zinkoxid. Kredit:Din Ping Tsai, National Taiwan University Lyd -cder, alt raseri i 90erne, synes mere og mere forælde
Drejning af cd'er for at rense spildevandDette billede viser en optisk disk, der er fuldstændig belagt med nanoroder af zinkoxid. Kredit:Din Ping Tsai, National Taiwan University Lyd -cder, alt raseri i 90erne, synes mere og mere forælde
- Huawei exec:Kinesisk teknologigigant ønsker at være gennemsigtig
- Sådan beregnes området af et rum
- Fødsel af et sort hul eller neutronstjerne fanget for første gang
- Slovakiske Wastebusters på korstog mod affald
- ALMA fanger oprørt planetfabrik
- Største undersøiske jordskred afsløret på Great Barrier Reef


