Meget følsom nanosensor registrerer subtile kaliumændringer i hjernen
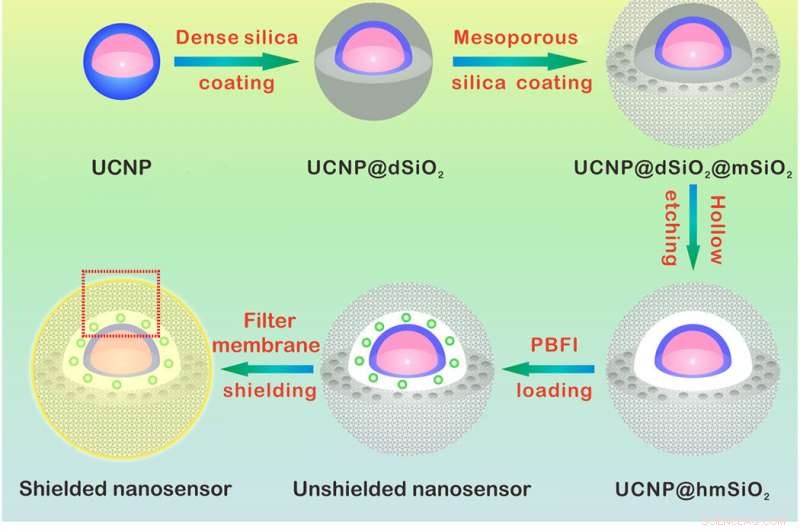
Design og sensormekanisme for K+ nanosensoren. (A) Skematisk illustration til syntesen af nanosensoren. NaYF4:Yb/Tm@NaYF4:Yb/Nd (UCNP) -kernen blev syntetiseret og overtrukket med et tæt silicagelag og en successiv mesoporøs silica -skal. Ætsning af det tætte silica lag danner et hul hulrum, der tillader belastning af PBFI. Nanosensoren blev til sidst belagt med den K+-selektive filtermembran. (B) skemaer, der viser et forstørret billede af nanosensoren [fra den røde prikboks i (A)] og dens K+ -føleringsmekanisme. Filtermembranlaget tillader kun K+ at diffundere ind og ud af nanosensoren, dermed udelukket interferens fra andre kationer. Når den er spredt ind i nanosensoren, K+ vil straks binde til PBFI. Ved NIR -bestråling, det opkonverterede UV -lys fra UCNP'erne ophidser PBFI, hvilket fører til emission af K+-bundet PBFI. Kredit:Science Advances, doi:10.1126/sciadv.aax9757
Forskere har udviklet en række kaliumioner (K + ) sonder til at detektere svingende K + koncentrationer under en række biologiske processer. Imidlertid, sådanne sonder er ikke følsomme nok til at detektere fysiologiske udsving i levende dyr, og det er ikke let at overvåge dybe væv med excitationer med kort bølgelængde, der er i brug indtil nu. I en ny rapport, Jianan Liu og et team af forskere inden for neurovidenskab, kemi, og molekylær teknik i Kina, beskrive en meget følsom og selektiv nanosensor for nær infrarød (NIR) K + ionbilleddannelse i levende celler og dyr. Holdet konstruerede nanosensoren ved at indkapsle upconversion -nanopartikler (UCNP'er) og en kommerciel kaliumionindikator i det hule hulrum af mesoporøse silica -nanopartikler og belægge dem med en K + selektiv filtermembran. Membranen adsorberede K + fra mediet og filtrerede eventuelle forstyrrende kationer væk. I sin virkningsmekanisme, UCNP'er konverterede NIR til ultraviolet (UV) lys for at ophidse kaliumionindikatoren og detektere svingende kaliumionkoncentrationer i dyrkede celler og i dyremodeller af sygdomme, herunder mus og zebrafisklarver. Resultaterne er nu offentliggjort den Videnskab fremskridt .
Det mest rigelige intracellulære kationkalium (K + ) er ekstremt afgørende i en række biologiske processer, herunder neuraltransmission, hjerteslag, muskelsammentrækning og nyrefunktion. Variationer i det intracellulære eller ekstracellulære K + koncentration (heri betegnet [K + ]) foreslår unormale fysiologiske funktioner, herunder hjertedysfunktion, Kræft, og diabetes. Som resultat, forskere er ivrige efter at udvikle effektive strategier til at overvåge dynamikken i [K + ] udsving, specifikt med direkte optisk billeddannelse.
De fleste eksisterende sonder er ikke følsomme over for K + påvisning under fysiologiske forhold og kan ikke differentiere udsving mellem [K + ] og den medfølgende natriumion ([Na + ]) under transmembrantransport i Na + /K + pumper. Mens fluorescens levetid billeddannelse kan skelne K + og Na + i vandopløsning, metoden kræver specialiserede instrumenter. De fleste K + sensorer aktiveres også med kort bølgelængde, herunder ultraviolet (UV) eller synligt lys - hvilket fører til betydelig spredning og begrænset indtrængningsdybde ved undersøgelse af levende væv. I modsætning, den foreslåede nær-infrarøde (NIR) billeddannelsesteknik vil tilbyde unikke fordele under dybvævsbilleddannelse som et sandsynligt alternativ.
Strukturel karakterisering af K+ nanosensoren. (A til C) Højvinklede ringformede mørkefeltbilleder af UCNP@dSiO2 (A), UCNP@dSiO2@mSiO2 (B), og UCNP@hmSiO2 (C). (D) Scanning elektronmikroskopi (SEM) billede af den afskærmede nanosensor. (E) SEM -billede af den afskærmede nanosensor nedsænket i en vandig opløsning indeholdende 150 mM Na+, 150 mM K+, 2 mM Ca2+, 2 mM Mg2+, 50 μM Fe2+, 2 mM Zn2+, 50 μM Mn2+, og 50 μM Cu2+. (F) EDS elementære liniescanningsprofiler langs den hvide linje i (E) afslører, at kun K+ -signaler er til stede i mesoporer og hule hulrum i de afskærmede nanosensorer. Kredit:Science Advances, doi:10.1126/sciadv.aax9757 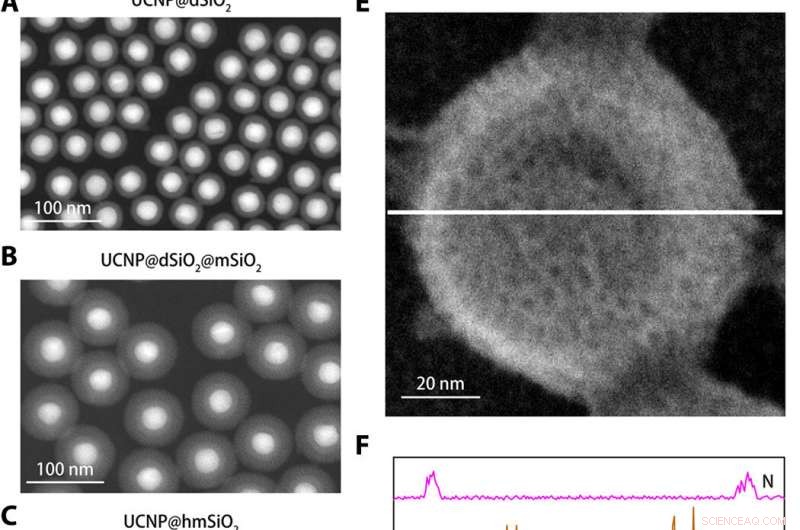
For at konstruere nanosensoren, Liu et al. indkapslede upconversion nanopartikler (UCNP'er) og en kommerciel K + indikator-kaliumbindende benzofuranisophthalat (PBFI) ind i kernen af mesoporøse silica-nanopartikler (MSN'er). UCNP'erne var i stand til at konvertere NIR -lys til UV -lys og begejstre acceptoren for K + indikator gennem luminescensresonans energioverførsel. De afskærmede den ydre overflade af silica nanopartikler med et tyndt lag K + selektiv filtermembran med mikroporer skabt af carbonyl oxygen for specificitet. Opsætningen favoriserede gratis overførsel af K + gennem membranporen, samtidig med at andre biologisk relevante kationer forhindres i at diffundere igennem. Teknikken tillod dem at detektere små udsving i [K + ] i løsningen. Teamet brugte transmissionselektronmikroskopi (TEM) til at observere den velkontrollerede struktur og udseende af nanopartiklerne under hvert trin i nanosensorkonstruktionen. Dynamisk lysspredning bekræftede tilstedeværelsen af en filtermembran på overfladen af den afskærmede nanosensor.
Billeddannelse af K+ efflux i HEK 293 -celler. (A) skemaer, der viser påvisning af K+ efflux ved hjælp af en streptavidinkonjugeret nanosensor, som er bundet til en biotinmodificeret celle. (B) konfokalmikroskopibilleder, der viser fluorescensen (ved 400 til 500 nm og 500 til 600 nm) af nanosensor-mærkede HEK 293-celler på forskellige tidspunkter efter behandling med K+ efflux-stimulatoren (en blanding af 5 uM nigericin, 5 μM bumetanid, og 10 μM ouabain). (C) Tidsforløb af nanosensor fluorescens variationer og beregnet tidsafhængighed af K+ efflux rate efter behandling med K+ efflux stimulator. (D) Tidsafhængige fluorescensudsving i afskærmede nanosensor-mærkede HEK 293-celler efter behandlinger med forskellige koncentrationer (20, 40, 60, 80, og 100%) af K+ effluxstimulator. Resultater fra fem uafhængige eksperimenter blev opsummeret som middelværdi ± SEM i (C) og (D). Kredit:Science Advances, doi:10.1126/sciadv.aax9757 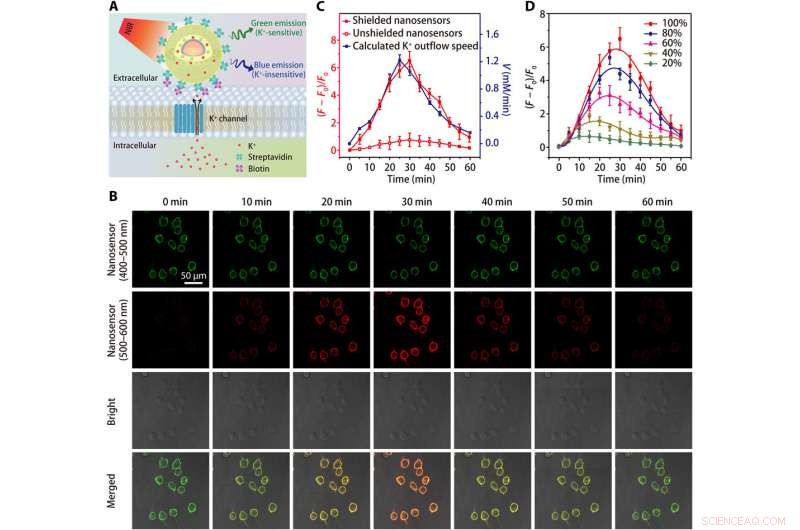
Teamet testede den øgede følsomhed af den afskærmede nanosensor i et fysiologisk område (0 til 150 mM) og viste en 12-faldig stigning i fluorescensintensitet sammenlignet med uskærmede nanosensorer. K + prober måtte vise høj selektivitet mod Na + , som Liu et al. verificeret ved hjælp af den afskærmede nanosensor ved hurtigt at opdage konsekvent fluorescensfølsomhed over for svingende [K + ], mens det forbliver upåvirket af stigende [Na + ].
Da levende celler er afhængige af natrium-kalium adenosintrifosfatase (Na + /K + pumpe) for at opretholde en stejl [K + ] gradient hen over deres plasmamembran, processen er delvist ansvarlig for cellens energiforbrug. Defekter i cellulær energimetabolisme kan føre til tab af [K + ] gradient, mens det giver anledning til ekstracellulær [K + ] kendt som [K + ] 0, som forskerne overvågede for at opnå en værdifuld indikator for cellelevedygtighed og vækst. Derefter, de øgede nanosensorens specificitet til at detektere celledød eller proliferationshastigheder ved podning af polyethylenglycol (PEG) på overfladen af nanosensorer i et kulturmedium indeholdende den humane embryonale nyre 293 -cellelinie. De optimerede derefter protokollen ved at forankre et stort antal nanosensorer på cellemembraner ved hjælp af streptavidinkonjugerede nanosensorer til biotinmodificerede celler. Resultaterne fremhævede forbedret følsomhed af afskærmede nanosensorer til løbende at overvåge K + udstrømning.
K+ billeddannelsesresultater af den afskærmede nanosensorer-behandlede musehjerne ved initiering af spredning af depression ved KCl-udløsning. Videoen i fuld længde er otte gange hurtigere end den reelle hastighed. Kredit:Science Advances, doi:10.1126/sciadv.aax9757 
Holdet anvendte derefter den afskærmede nanosensor til at undersøge cortikal spredningsdepression (CSD) i musens hjerne som en bølgelignende spredning af neural aktivitet. Processen involverer typisk en langsom udbredelsesfrigivelse af K + i den kortikale overflade og kunne udløses i musens hjerne via kaliumchlorid (KCl) inkubation. Forskerne overvågede samtidigt det lokale feltpotentiale og det optiske signal gennem det kirurgiske kranievindue og observerede en bølge af stigende [K + ] 0 formerer sig gradvist over cortex efter stimulering. Liu et al. observerede ikke en bølge i mus injiceret med uskærmede nanosensorer, angiver betydningen af det ydre filter for forbedret følsomhed af nanosensoren. Den registrerede bølgehastighed varierede ikke signifikant fra de værdier, der blev opnået ved hjælp af blod-iltniveauafhængig magnetisk resonansbilleddannelse (MRI) hos patienter med migræne-aura.
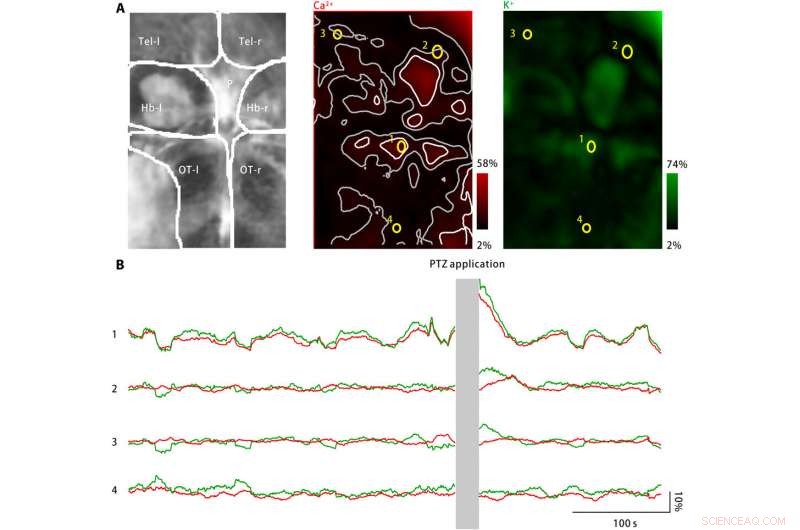
Ekstracellulær kalium burst i larve zebrafisk hjerne efter PTZ behandling. (A) PTZ -behandling inducerede stigninger i både neuronal calciumaktivitet (midten) og ekstracellulær kaliumkoncentration (højre). Venstre:Afbildede hjerneområder omfatter venstre og højre telencephala (Tel-l og Tel-r, henholdsvis), venstre og højre habenulae (Hb-l og Hb-r, henholdsvis), pineallegemet (P), og den venstre og højre optiske tecta (OT-l og OT-r, henholdsvis). Midt:Neuronal calciumaktivitet blev overvåget ved hjælp af en genetisk udtrykt calciumindikator, jRGECO1a. Den målte responsamplitude er kodet med rødt og kortlagt tilbage til det afbildede hjerneområde. Spredte aktivitetspletter er markeret som hvide, og deres nærliggende zoner er markeret som grå. Fire ROI'er (gul) er valgt. Til højre:Ekstracellulær kaliumkoncentration blev overvåget ved hjælp af kaliumnanosensoren. Den målte responsamplitude er kodet med grønt og kortlagt tilbage til det afbildede hjerneområde. (B) Neuronal calciumaktivitet (rød) og ekstracellulære kaliumkoncentrationer observeret for de fire repræsentative ROI'er er markeret i (A). Efter PTZ ansøgning, både neuronal calciumaktivitet og ekstracellulær kaliumkoncentration er steget på flere aktivitetssteder, herunder pineallegemet og den forreste optiske tecta, som repræsenteret ved ROI1. På tilstødende zoner af aktivitetsstederne, neuronal calciumaktivitetsændring er fraværende eller minimal, mens den ekstracellulære kaliumkoncentration fortsætter med at stige (ROI2 og ROI3). Imidlertid, i området langt fra aktivitetsstederne (ROI4), hverken neuronal calciumaktivitet eller ekstracellulær kaliumkoncentration er steget. Kredit:Science Advances, doi:10.1126/sciadv.aax9757
For at udvide applikationer af nanosensoren, Liu et al. overvågede neuronale calciumniveauer og ekstracellulære kaliumkoncentrationer ved hjælp af zebrafisklarver. Mens en stor stigning i den ekstracellulære kaliumkoncentration kan forårsage intens neuronal aktivering til at forårsage CSD og epilepsi, der findes ingen direkte beviser for at vise ændringer i ekstracellulært kalium under sygdommen. Holdet konstruerede derfor en sygdomsmodel ved hjælp af zebrafisklarver for at øge ekstracellulære kaliumkoncentrationer og observerede sygdomskarakteristisk neuronal aktivering i bestemte hjerneområder.
På denne måde, Jianan Liu og kolleger konstruerede en kaliumion -nanosensor med ekstremt høj følsomhed og selektivitet. Den ydre belægning af en selektiv filtermembran forbedrede selektiviteten, følsomhed, og kinetik for enheden til hurtig og kvantitativ [K + ] påvisning i levende celler og intakte hjerner. Den afskærmede nanosensor vil have brede anvendelser inden for hjerneforskning for at forbedre forståelsen af unormal [K + ] -relaterede sygdomme. Metoden sammen med optisk fiberbaseret endoskop og fotometri tillader realtids kaliumbilleddannelse i frit bevægelige dyr.
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Forskere blander atomlag som spillekort for at lave nye kvantematerialerKredit: Fremskridt i nanoskala Materialeforskere kan nu blande lagdelte forbindelser sammen, meget som at kombinere to forskellige spil kort. Teknikken, for nylig opdaget af et team af forskere v
Forskere blander atomlag som spillekort for at lave nye kvantematerialerKredit: Fremskridt i nanoskala Materialeforskere kan nu blande lagdelte forbindelser sammen, meget som at kombinere to forskellige spil kort. Teknikken, for nylig opdaget af et team af forskere v -
 Team lægger vægt på højtydende carbon nanorørfibre til industrienTværsnittet af en fiber produceret på Rice University indeholder titusinder af kulstof nanorør. Laboratoriet forbedrer løbende sin metode til fremstilling af fibre, som test viser nu er stærkere end K
Team lægger vægt på højtydende carbon nanorørfibre til industrienTværsnittet af en fiber produceret på Rice University indeholder titusinder af kulstof nanorør. Laboratoriet forbedrer løbende sin metode til fremstilling af fibre, som test viser nu er stærkere end K -
 Kombination af modsatrettede egenskaber for synergistisk funktionKredit:Thinkstock Egenskaberne af nanomaterialer adskiller sig ofte på nye måder fra egenskaberne for bulkmaterialet af de samme stoffer. Europæiske forskere undersøgte en helt ny klasse af sådann
Kombination af modsatrettede egenskaber for synergistisk funktionKredit:Thinkstock Egenskaberne af nanomaterialer adskiller sig ofte på nye måder fra egenskaberne for bulkmaterialet af de samme stoffer. Europæiske forskere undersøgte en helt ny klasse af sådann -
 Nanoworld sneslyngemaskiner skærer lige kanaler i halvlederoverfladerKredit:NIST I nanoverdenen, små partikler af guld kan fungere som sneslynge, kværning gennem overfladelag af en vigtig klasse af halvledere for at grave fejlfrit lige stier. Den overraskende nedgr
Nanoworld sneslyngemaskiner skærer lige kanaler i halvlederoverfladerKredit:NIST I nanoverdenen, små partikler af guld kan fungere som sneslynge, kværning gennem overfladelag af en vigtig klasse af halvledere for at grave fejlfrit lige stier. Den overraskende nedgr
- Institutionelle miljøer fanger handicappede geovidenskabsmænd mellem en klippe og en arbejdsplads
- Gennemgang af Dakota Access-olierørledningen skal forlænges til foråret
- Lys i mørket:Ny opdagelse gør mikroskopisk billeddannelse mulig under mørke forhold
- Forbedring af forudsigelsesmodellen for spansk elnets sårbarhed i solstorme
- Forskning finder sammenhæng mellem nedbør og havcirkulation i fortid og nutid
- Kraftig smog, forværret af vejret, vækker alarm i hele Asien


