Forskere afslører, hvordan celler interagerer med støttende proteiner for at hele sår
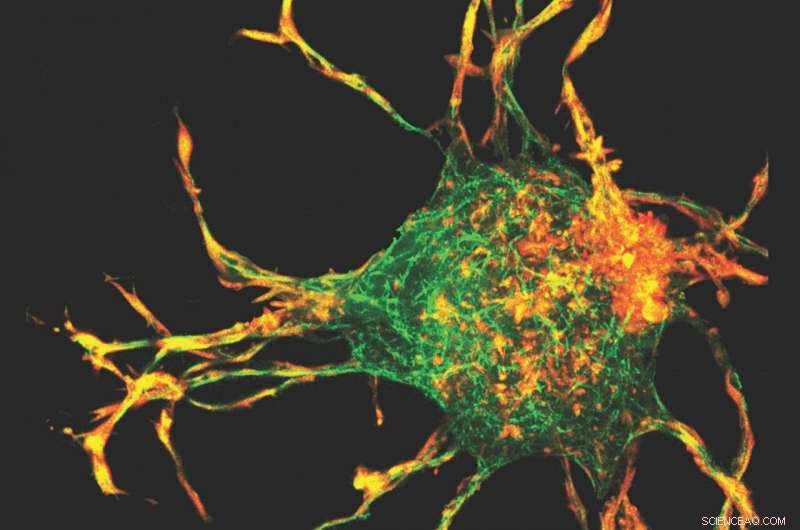
Forskere brugte en 3D-kortlægningsteknik - første gang den er blevet anvendt på kollagen - sammen med en beregningsmodel til at beregne 3D-belastnings- og stressfelterne skabt af fremspring fra cellerne. Kredit:Høflighed billede
Når vi får et sår på vores hud, cellerne i vores kroppe mobiliserer hurtigt for at reparere det. Mens det har været kendt, hvordan celler heler sår, og hvordan ar dannes, et hold ledet af forskere fra Washington University i St. Louis har for første gang fastslået, hvordan processen begynder, som kan give ny indsigt i sårheling, fibrose og kræftmetastaser.
Holdet, ledet af Delaram Shakiba, en postdoc-stipendiat fra NSF Science and Technology Center for Engineering Mechanobiology (CEMB) ved McKelvey School of Engineering, opdagede måden fibroblaster, eller almindelige celler i bindevæv, interagere med den ekstracellulære matrix, som giver strukturel støtte samt biokemiske og biomekaniske signaler til celler. Holdet afslørede en rekursiv proces, der foregår mellem cellerne og deres miljø samt strukturer i cellerne, som tidligere var ukendte.
Resultaterne af undersøgelsen blev offentliggjort i ACS Nano den 28. juli. Seniorforfattere på avisen er Guy Genin, Harold og Kathleen Faught professor i maskinteknik ved McKelvey School of Engineering, og Elliot Elson, professor emeritus i biokemi og molekylær biofysik ved School of Medicine.
"Klinisk indsats for at forhindre progression af fibrokontraktile sygdomme, såsom ardannelse og fibrose, stort set har været mislykket, dels fordi de mekanismer, som celler bruger til at interagere med proteinfibrene omkring dem, er uklare, "Shakiba sagde. "Vi fandt ud af, at fibroblaster bruger helt forskellige mekanismer i de tidlige - og jeg tror de mest behandlelige - stadier af disse interaktioner, og at deres reaktioner på stoffer derfor kan være det modsatte af, hvad de ville være i de senere stadier."
Genin, hvem er meddirektør for CEMB, sagde, at processen har hindret mekanobiologi-forskere i nogen tid.
"Forskere inden for mekanobiologi troede, at celler trak kollagen ind fra den ekstracellulære matrix ved at række ud med lange fremspring, tager fat i det og trækker det tilbage, " sagde Genin. "Vi opdagede, at dette ikke var tilfældet. En celle skal først presse sig ud gennem kollagen, så i stedet for at tage fat, det skyder i det væsentlige små hår, eller filopodia, ud af siderne af dens arme, trækker kollagen ind på den måde, trækker sig derefter tilbage."
Nu hvor de forstår denne proces, Genin sagde, de kan kontrollere den form, en celle tager.
"Med vores kolleger på CEMB ved University of Pennsylvania, vi var i stand til at validere nogle matematiske modeller for at gå gennem ingeniørprocessen, og vi har nu de grundlæggende regler, som celler følger, " sagde han. "Vi kan nu begynde at designe specifikke stimuli til at lede en celle til at opføre sig på en bestemt måde i opbygningen af en vævskonstrueret struktur."
Forskerne lærte, at de kunne kontrollere celleformen på to måder:For det første, ved at kontrollere grænserne omkring det, og for det andet, ved at hæmme eller opregulere særlige proteiner involveret i remodelleringen af kollagenet.
Fibroblaster trækker kanterne af et sår sammen, får det til at trække sig sammen eller lukke sig. Kollagen i cellerne omformer derefter den ekstracellulære matrix for helt at lukke såret. Det er her, mekanobiologi kommer i spil.
"Der er en balance mellem spænding og kompression inde i en celle, der for nylig er blevet udsat for fibrøse proteiner, " sagde Genin. "Der er spændinger i aktin kabler, og ved at lege med den balance, vi kan få disse fremspring til at vokse ekstremt lange, " sagde Genin. "Vi kan stoppe ombygningen i at finde sted, eller vi kan øge den."
Holdet brugte en 3-D-kortlægningsteknik - første gang den er blevet anvendt på kollagen - sammen med en beregningsmodel til at beregne 3D-belastnings- og stressfelterne skabt af fremspringene fra cellerne. Da celler akkumulerede kollagen, spændingsdrevet ombygning og tilpasning af kollagenfibre førte til dannelsen af kollagenkanaler. Dette kræver samarbejdsinteraktioner mellem celler, hvorigennem celler kan interagere mekanisk.
"Nye metoder til mikroskopi, vævsteknik og biomekanisk modellering forbedrer i høj grad vores forståelse af de mekanismer, hvorved celler modificerer og reparerer det væv, de befolker, " sagde Elson. "Fibrøse cellulære strukturer genererer og styrer kræfter, der komprimerer og reorienterer deres ekstracellulære fibrøse miljø. Dette rejser nye spørgsmål om de molekylære mekanismer af disse funktioner, og hvordan celler regulerer de kræfter, de udøver, og hvordan de styrer omfanget af matrixdeformation."
"Sårheling er et godt eksempel på, hvordan disse processer er vigtige på en fysiologisk måde, " sagde Genin. "Vi vil være i stand til at komme med indsigt i, hvordan man træner celler til ikke at komprimere kollagenet omkring dem for meget."
 Varme artikler
Varme artikler
-
 Eksperimenter i amorft kulstof-monolag giver nye beviser til fysikdebattenAtomstruktur af MAC fra TEM. Kredit: Natur (2020). DOI:10.1038/s41586-019-1871-2 Plast, glas og geler, også kendt som bulk amorfe materialer, er hverdagsgenstande for os alle. Men for forskere, d
Eksperimenter i amorft kulstof-monolag giver nye beviser til fysikdebattenAtomstruktur af MAC fra TEM. Kredit: Natur (2020). DOI:10.1038/s41586-019-1871-2 Plast, glas og geler, også kendt som bulk amorfe materialer, er hverdagsgenstande for os alle. Men for forskere, d -
 Forskere designer tilpassede nanopartikler med ny stencilmetodeNanopartiklerne formes ved at belægge nye molekyler på visse dele af deres overflader. Kredit:Chen &Gibson et al. Partikler i nanostørrelse gør allerede cykler og tennisketchere lettere og stærker
Forskere designer tilpassede nanopartikler med ny stencilmetodeNanopartiklerne formes ved at belægge nye molekyler på visse dele af deres overflader. Kredit:Chen &Gibson et al. Partikler i nanostørrelse gør allerede cykler og tennisketchere lettere og stærker -
 Første transportmålinger afslører spændende egenskaber ved germanenGermanane omdannes til germanen ved termisk udglødning, som fjerner brinten (rød). Kredit:Ye Lab / University of Groningen Germanen er et 2D-materiale afledt af germanium og relateret til grafen.
Første transportmålinger afslører spændende egenskaber ved germanenGermanane omdannes til germanen ved termisk udglødning, som fjerner brinten (rød). Kredit:Ye Lab / University of Groningen Germanen er et 2D-materiale afledt af germanium og relateret til grafen. -
 En ny måde at fremstille dobbeltlagsgrafen af højere kvalitetVækst af store BLG-domæner på den udvendige overflade af en OR-Cu-lomme. Kredit: Natur nanoteknologi (2016). DOI:10.1038/nnano.2015.322 (Phys.org) – Et team af forskere med medlemmer fra institut
En ny måde at fremstille dobbeltlagsgrafen af højere kvalitetVækst af store BLG-domæner på den udvendige overflade af en OR-Cu-lomme. Kredit: Natur nanoteknologi (2016). DOI:10.1038/nnano.2015.322 (Phys.org) – Et team af forskere med medlemmer fra institut
- Her er, hvordan Facebooks annonceleveringssystem gør den amerikanske politiske kløft endnu bredere
- Sådan identificerer du animalske fodtryk
- Undersøgelse:Kunstnerisk anerkendelse afhænger af en signaturstil eller outputtempoet
- Tre måder at atmosfæren hjælper levende ting overleve på jorden
- Atomafbrydere ved plasmonisk opvarmning af metalliske kontaktpunkter
- Hvordan små robotter kan forbedre din sundhed fra inde i kroppen


