Guld nanopartikler sætter fokus på lægemiddelkandidater i celler
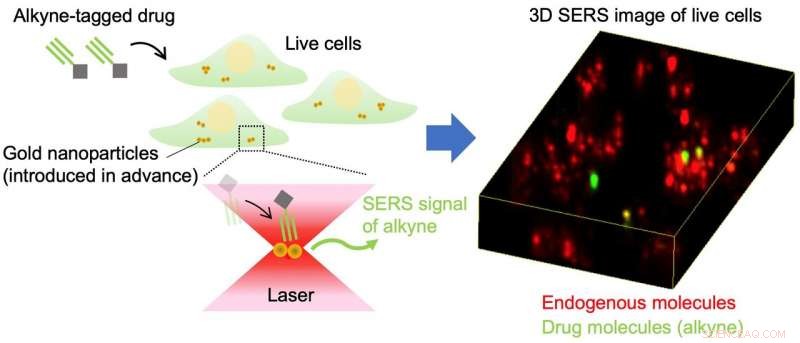
Fig.1 Skematisk illustration af alkynmærket lægemiddeldetektion med små molekyler i levende celler ved brug af overfladeforstærket Raman-spredning af guldnanopartikler. Kredit:Osaka University
Succesfuld udvikling af lægemidler har en betydelig indflydelse på menneskers livskvalitet på verdensplan. At være i stand til at spore, hvordan molekyler kommer ind i målceller, og observere, hvad de gør, når de er inde, er nøglen til at identificere de bedste kandidater. Analyseteknikker udgør derfor en vigtig del af lægemiddelopdagelsesprocessen. Forskere fra Osaka University, i samarbejde med RIKEN, har rapporteret en Raman-mikroskopi-baseret tilgang til visualisering af småmolekylære lægemidler, der bruger guld nanopartikler. Holdets resultater offentliggøres i ACS Nano .
Små lægemiddelmolekyler spores ofte ved at fastgøre dem til fluorescerende prober, der er synlige, når de bestråles med lys. Mikroskopi kan derefter bruges til at se disse molekyler inde i celler i realtid. Imidlertid, fluorescerende molekyler kan være omfangsrige, hvilket kan påvirke den måde, de små molekyler opfører sig på. Derudover nogle fluorescerende molekyler mister deres fluorescens, hvis de udsættes for for meget lys, gør det svært at se dem i løbet af lange studier.
Et alternativ til fluorescerende etiketter er et meget mindre tag kendt som en alkyn, som består af kulstof-kulstof tripelbindinger. Det særlige arrangement af atomer i alkyner findes ikke naturligt i celler; derfor, de giver en meget specifik markør. Desuden, deres lille størrelse betyder, at alkyner har minimal effekt på småmolekylernes adfærd. I stedet for at udsende fluorescens under laserlys, alkyner producerer det, der er kendt som et Raman-signal, som tydeligt kan identificeres blandt cellematerialesignalerne.
Imidlertid, Det er vanskeligt at lede efter Raman-signalet for alkyngrupper, når der ikke er mange af dem på grund af Raman-spredningens lave effektivitet. Forskerne har derfor kombineret alkynmærkning med brugen af guldnanopartikler. Surface-enhanced Raman scattering (SERS) mikroskopi kan stimulere guldnanopartikler til at producere forbedrede elektriske felter, der booster Raman-signalet fra alkyngrupperne, gør dem nemmere at opdage.
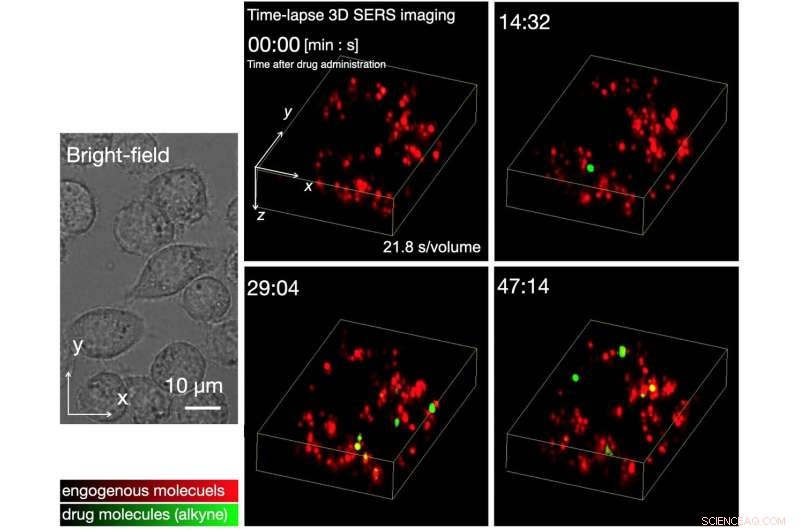
Fig. 2 Time-lapse 3D SERS-billeddannelse af små molekylers optagelse af levende celler. Vi har med succes observeret, at SERS-signalerne for alkyner oprindeligt blev detekteret omkring 10–15 minutter efter lægemiddeladministration, og antallet af signaler steg gradvist over tid. Lægemiddeladministrationskoncentrationen var 20 µM. Kredit:Osaka University
"Vores tilgang er en kombination af teknikker, der er blevet brugt til at spore små molekyler i levende celler, " Studielederforfatter Kota Koike forklarer. "Guldnanopartikler er særligt nyttige budbringere til at rapportere tilstedeværelsen af alkyngrupper, fordi de forbedrer alkynsignalet, samt give en overflade, som alkynerne kan lide at interagere med. De to komponenter kommer derfor naturligt sammen for at generere det forbedrede signal."
Guld nanopartikler optages let af adskillige forskellige typer celler, gør teknikken bredt anvendelig. Nanopartiklerne kommer ind i lysosomrummene inde i cellen og forstærker derefter signalet fra de alkynmærkede molekyler, der efterfølgende ankommer til lysosomerne og interagerer med dem.
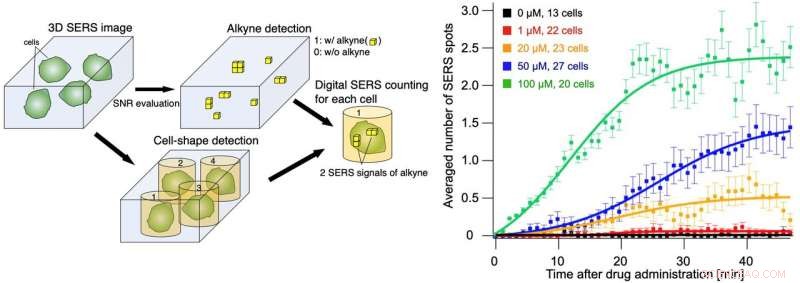
Fig. 3 Kvantitativ påvisning af antallet af SERS-signaler for alkyner på enkeltcelleniveau (venstre figur). Antallet af SERS-signaler detekteret pr. celle ved hver administrationskoncentration over tid (højre). Ved at bruge den kvantitative SERS-detektionsmetode observerede vi med succes, at optagelseshastigheden i høj grad afhang af lægemiddelkoncentrationen. Kredit:Osaka University
"Vores SERS-teknik har potentialet til at blive brugt med en række forskellige celletyper såvel som et stort set ubegrænset antal lægemiddelkandidater, ", forklarer den tilsvarende forfatter Katsumasa Fujita. "Dette er særligt spændende for lægemiddelopdagelse, hvor ethvert middel til bedre forståelse af lægemiddeldynamikken i realtid er ekstremt værdifuldt for udviklingen."
 Varme artikler
Varme artikler
-
 Forskere udvikler platform til at bygge nanoelektronik og kvanteprocessorerMåleopsætning og type-z SOT-omskiftning. (a) Tværstangsgeometri med Ix, Hej, σsw, og σbi indeni. (b) Ikke-flygtig målesekvens. Skrive- og læseprocesser er adskilt i tidsdomænet. (c) Anomal Hall-modsta
Forskere udvikler platform til at bygge nanoelektronik og kvanteprocessorerMåleopsætning og type-z SOT-omskiftning. (a) Tværstangsgeometri med Ix, Hej, σsw, og σbi indeni. (b) Ikke-flygtig målesekvens. Skrive- og læseprocesser er adskilt i tidsdomænet. (c) Anomal Hall-modsta -
 Forskere udvikler en tilgang til at syntetisere ukonventionelle nanolegeringer til elektrokatalytisk…Kredit:CC0 Public Domain Metalliske legeringer på nanometerskala (nanolegeringer) har et stort potentiale i elektrokatalyse. Interaktionen mellem forskellige komponenter i nanolegeringer kan ændre
Forskere udvikler en tilgang til at syntetisere ukonventionelle nanolegeringer til elektrokatalytisk…Kredit:CC0 Public Domain Metalliske legeringer på nanometerskala (nanolegeringer) har et stort potentiale i elektrokatalyse. Interaktionen mellem forskellige komponenter i nanolegeringer kan ændre -
 Forskere udvikler kvantemembraner - en ny klasse af 2D-halvledere(PhysOrg.com) - Et team af forskere, der arbejder fra University of California, Berkeley, har udviklet en helt ny klasse af todimensionelle halvledere lavet af indiumarsenid. Kaldes kvantemembraner, d
Forskere udvikler kvantemembraner - en ny klasse af 2D-halvledere(PhysOrg.com) - Et team af forskere, der arbejder fra University of California, Berkeley, har udviklet en helt ny klasse af todimensionelle halvledere lavet af indiumarsenid. Kaldes kvantemembraner, d -
 Attosecond kamera til nanostrukturerNår laserlys interagerer med en nanoneedle (gul), elektromagnetiske nærfelter dannes på overfladen. En anden laserpuls (lilla) skubber en elektron (grøn) ud af nålen, som kan bruges til at karakterise
Attosecond kamera til nanostrukturerNår laserlys interagerer med en nanoneedle (gul), elektromagnetiske nærfelter dannes på overfladen. En anden laserpuls (lilla) skubber en elektron (grøn) ud af nålen, som kan bruges til at karakterise
- Hvilke planter vokser i Det Indiske Ocean?
- Billede:Røg og brande lyser op i Pacific Northwest
- Fem grundlæggende kendetegn ved Fish
- Tandmateriale til blækspruttesugerring kan hjælpe med rekonstruktiv kirurgi, tjene som øko-emball…
- Skov- og havrester styrker maven
- NASA ser vindskydning stadig ramme den tropiske storm Iselle


