Udviklingen af enkelte amyloidfibriller til mikrokrystaller

Nanomekaniske egenskaber af ILQINS fibriller. a) AFM højde, b) 3D AFM højde, c) AFM amplitude, og d) AFM DMT-modul af ILQINS-fibriller. e) DMT-modul af ILQINS-fibriller fra del (d). f) Histogrammet af DMT moduli af ILQINS fibriller. Kredit: Avanceret Videnskab , doi:10.1002/advs.202002182
Amyloider refererer til unormale fibrøse ekstracellulære og proteinholdige aflejringer fundet i organer og væv, der danner uopløselige konstruktioner, der er modstandsdygtige over for nedbrydning. Deres dannelse kan ledsage sygdom, hvor hver sygdom er karakteriseret ved et specifikt protein eller peptidaggregat. De nanomekaniske egenskaber af amyloidfibriller og nanokrystaller afhænger af deres sekundære og kvaternære struktur og intermolekylære geometri. Forskere har brugt avancerede billeddannelsesmetoder, herunder atomkraftmikroskopi (AFM) til at optrevle den morfologiske og mekaniske heterogenitet af amyloider, selvom det er svært at opnå en fuld forståelse baseret på konventionelle spektroskopiske metoder.
I en nylig rapport, der nu er offentliggjort den Avanceret Videnskab , Jozef Adamcik og et internationalt team af forskere ved ETH Zürich, University of Cambridge, Universitetet i Luxemburg og Shanghai Universitet, demonstreret kombinerede enkeltmolekyle nanospektroskopimetoder. De kombinerede teknikkerne med atommodellering for at forstå den strukturelle overgang af amyloidfibriller til amyloidmikrokrystaller baseret på hexapeptider på nanoskala. De krediterede oprindelsen af afstivning til et øget indhold af intermolekylære β-arkstrukturer. Den øgede stivhed i Youngs moduli korrelerede med øget tæthed af intermolekylær hydrogenbinding og parallelle β-arkstrukturer for energisk at stabilisere krystallerne.
Amyloider i materialevidenskab
Amyloider er højt ordnede strukturer, der stammer fra proteiner eller peptider og er forbundet med en række sygdomme, herunder adskillige neurodegenerative lidelser såsom Alzheimers, Parkinsons, Creutzfeldt-Jakobs sygdom, og bovin spongiform encephalopati. At forstå deres biofysiske egenskaber kan give masser af ny information til at hæmme deres dannelse. I materialevidenskab, imidlertid, et stort antal peptiders og proteiners evne til selv at samle sig til amyloide strukturer åbner op for en metode til at bruge dem til at udvikle nye nanomaterialer til biomedicinske og nanoteknologiske anvendelser. Som resultat, materialeforskere er ivrige efter at opnå detaljeret viden om strukturen og morfologien af amyloider i en bredere sammenhæng for anvendelser på tværs af medicin til nanoteknologi. I dette arbejde, Adamcik et al. undersøgte polymorfien af hexapeptid-modelsystemerne og brugte enkeltmolekyle-kapaciteterne af peakforce kvantitativ nanomekanisk kortlægning af atomkraftmikroskopi (PF-QNM-AFM) til analysen. Metoden kombinerede AFM (atomic force microscopy) og infrarøde teknikker med atommodellering for at studere og korrelere det nanomekaniske, kemiske og strukturelle egenskaber af fibrillen og dens krystalformer på skalaen af et enkelt aggregat.

Nanomekaniske egenskaber af IFQINS fibriller (F), mellemkrystaller (IC), og krystaller (C). a) AFM højde, b) 3D AFM højde, c) AFM amplitude, og d) AFM DMT-modul af IFQINS-fibriller. e) DMT-modul af IFQINS-fibriller fra del (d). f) Histogrammet af DMT-moduli af IFQINS-fibriller. Rød farve svarer til DMT-modulet af fibriller, grøn viser mellemkrystaller, og blå svarer til DMT-modulerne for krystaller. Kredit: Avanceret Videnskab , doi:10.1002/advs.202002182
Peak-force kvantitativ nanomekanisk kortlægning af atomkraftmikroskopi (PF-QNM-AFM)
Holdet analyserede først ILQINS hexapeptider (et amyloiddannende segment) individuelt for at forstå forskellen i nanomekaniske og strukturelle egenskaber. De udtog Young's moduli af omkring 30 forskellige fibriller med værdier (2-3 GPa) typiske for amyloidfibriller. De observerede derefter et andet hexapeptid IFQINS - et andet amyloiddannende segment, at vise sameksistensen af fibriller med en struktur af højrehåndede spiralformede bånd, højrehåndede og venstrehåndede snoede bånd, mellemkrystaller og krystaller. I dette tilfælde, de unges moduler var forskellige, og gjorde det muligt for forskerne at skelne mellem hver strukturel morfologi. For eksempel, fibrillerne vist med rødt havde Youngs modul i 2-3 GPa-området, meget ligesom fibriller, der var selvmonteret fra ILQINS. For krystaller afbildet i blåt, modulerne var i området 5-6 GPa, mens mellemkrystaller set i grønt var spredt over 2-5 GPa. Derudover TFQINS amyloidstrukturer selvsamlet til mikrokrystaller med et lille antal snoede bånd, med lignende tendenser til IFQINS hexapeptider. Holdet opnåede også detaljeret analyse af Young's moduli af en fibril-til-krystal overgang af TFQINS.
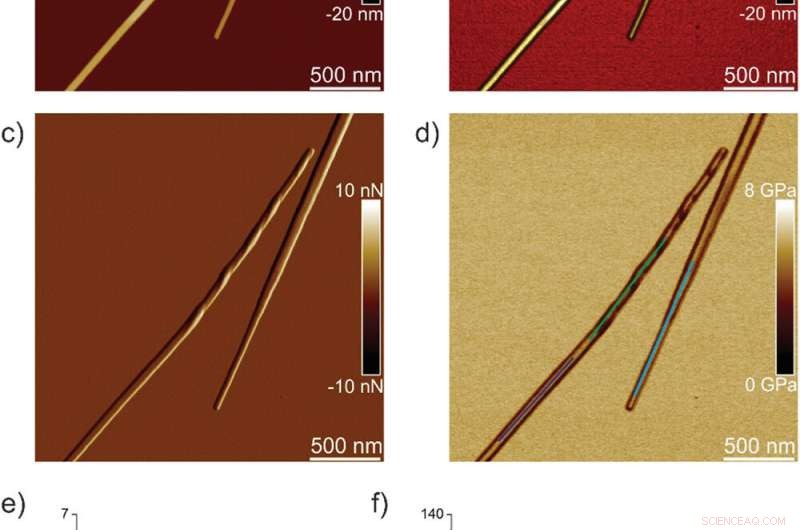
Nanomekaniske egenskaber af TFQINS-krystaller. a) AFM højde, b) 3D AFM højde, c) AFM amplitude, og d) AFM DMT-modul af TFQINS-krystaller. e) DMT-modul af TFQINS-krystaller fra del (d). f) Histogrammet af DMT-moduli af TFQINS-krystaller fra del (e). Kredit: Avanceret Videnskab , doi:10.1002/advs.202002182
Infrarød nanospektroskopi (AFM-IR)
Adamcik et al. derefter anvendt infrarød (IR) spektroskopi for yderligere at forstå sammenhængen mellem nanomekaniske egenskaber og den kemiske sekundære struktur heterogenitet af enkelte fibriller og krystaller. De valgte IFQINS-peptiderne til eksperimenterne med AFM-IR-værktøjet på grund af dets heterogenitet. Forskerne observerede morfologikort ved hjælp af teknikken til at vise sameksistensen af snoede fibriller og krystaller på nanoskala. AFM-IR-systemet tillod den spektroskopiske opløsning af amidbåndene, der typisk er kendt som fingeraftryk af proteiner eller peptider. Forskerne undersøgte de subtile strukturelle ændringer under overgangen fra den fibrillære til den mellemliggende krystal til krystaltilstanden, for at indikere en nettostigning i indholdet af intermolekylært parallelt β-ark og en lille stigning i antiparallel β-arkkonformation. Holdet krediterede resultatet til det øgede Youngs modul fra fibrillen til krystaltilstanden, hvor IR-spektroskopimetoden og AFM-indrykning gav en synopsis af atomskala-organisationen.
Atomiske simuleringer
Forskerne udførte derefter atomistiske simuleringer af indrykningsprocessen for yderligere at undersøge ændringerne i amyloidmaterialeegenskaber efter at have erhvervet den krystallignende orden. De brugte ILQINS-peptider til disse simuleringer for at forstå versioner af tykke og tynde amyloidmodeller. Den tynde struktur havde en mindre kompakt rygrad sammenlignet med den tykke struktur. Youngs moduli af krystaller oversteg dem for snoede amyloider med 3,6 GPa for at vise, at rækkefølgen af krystaller var større end fibriller, meget gerne med eksperimentel indrykning. Taget sammen, resultaterne viste fibril-til-krystal-overgang i amyloid at være forbundet med øget intermolekylær β-sheet og hydrogenbinding, der resulterede i skift af amid I-båndet til lavere vibrationsfrekvenser. Dette skift gjorde det muligt for krystalstrukturen at blive stabil baseret på vibrationsentropi og langrækkende rækkefølge af H-bindinger. Arbejdet gav en klar proces med fibril-til-krystal-overgange for at danne usædvanligt stabile amyloidlignende krystaller.
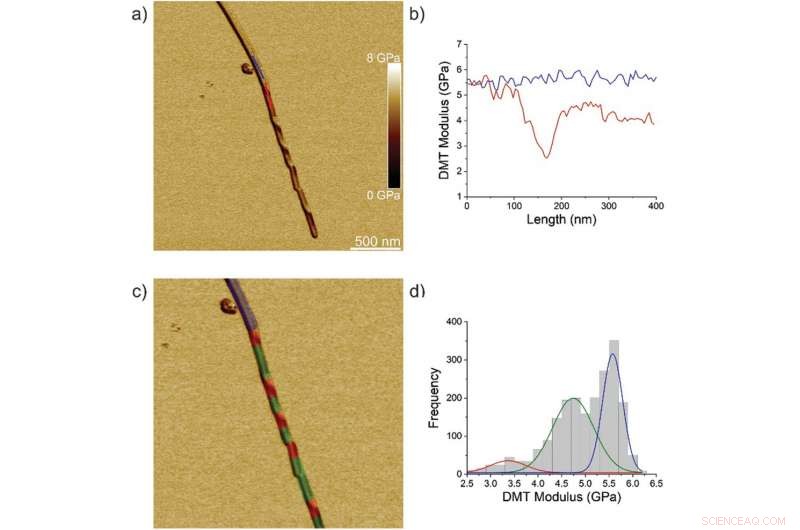
Nanomekaniske egenskaber af TFQINS fibril/krystal overgang. a) AFM DMT modul af TFQINS krystal. b) DMT-modul af TFQINS-krystallen fra del (a). c) AFM DMT modul af TFQINS krystal tonet rød, grøn eller blå af den tildelte region. d) Histogrammet af DMT-moduli af TFQINS-krystaller. Røde og grønne farver angiver snoede eller flade sektioner af fibril/krystal-overgangsområdet, henholdsvis; blå svarer til krystalområdet. Kredit: Avanceret Videnskab , doi:10.1002/advs.202002182
Outlook
På denne måde Jozef Adamcik og kolleger kombinerede enkeltmolekyle atomkraftmikroskopi, nanoindentation og nanoskala kemisk spektroskopi med atommodellering for at forstå de nanomekaniske og vibrationsegenskaber af amyloide polymorfer. De observerede overgangen fra fibriller til mikrokrystaller og undersøgte en række hexapeptidfragmenter (inklusive ILQINS, IFQINS, og TFQINS). Amyloidfibrillerne og mikrokrystallerne viste forskellige Youngs moduli, hvor amyloidkrystallerne havde større værdier på grund af den højere tæthed og rækkefølge af intermolekylære β-ark i mikrokrystalarkitekturerne. Værket gav et hidtil uset kort over det atomistiske, mesoskopisk, og vibrationsegenskaber af amyloidaggregatet for at uddybe den molekylære oprindelse af de termodynamisk stabile amyloidkrystaller til anvendelse på tværs af materialevidenskab til nanomedicin.
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Forskere afslører synergistiske virkninger i dobbelt enkeltatoms katalysatorSynergistiske virkninger for forbedret katalyse i en dobbelt atom-katalysator. Kredit:FU Junhong Single-atom katalysatorer (SACer) anvendes i heterogen katalyse. I stedet for én type enkelt atom,
Forskere afslører synergistiske virkninger i dobbelt enkeltatoms katalysatorSynergistiske virkninger for forbedret katalyse i en dobbelt atom-katalysator. Kredit:FU Junhong Single-atom katalysatorer (SACer) anvendes i heterogen katalyse. I stedet for én type enkelt atom, -
 Forskere har forvandlet gennemsigtig calcit til kunstigt guldFigur viser 3D-rekonstruktion af den gyldne vaterit og den laser-inducerede opvarmning af sfærulitterne. Kredit:Tel Aviv Universitet I et gennembrud inden for metamaterialer, for første gang i ver
Forskere har forvandlet gennemsigtig calcit til kunstigt guldFigur viser 3D-rekonstruktion af den gyldne vaterit og den laser-inducerede opvarmning af sfærulitterne. Kredit:Tel Aviv Universitet I et gennembrud inden for metamaterialer, for første gang i ver -
 Direkte skrivning af diamantmønstre fra grafit et potentielt teknologisk springDenne illustration viser en ny teknik, der bruger en pulserende laser til at skabe syntetiske nanodiamantfilm og -mønstre fra grafit, med potentielle anvendelser fra biosensorer til computerchips. Kre
Direkte skrivning af diamantmønstre fra grafit et potentielt teknologisk springDenne illustration viser en ny teknik, der bruger en pulserende laser til at skabe syntetiske nanodiamantfilm og -mønstre fra grafit, med potentielle anvendelser fra biosensorer til computerchips. Kre -
 Undersøgelse af nye måder at styre termisk stråling påKredit:Lawrence Berkeley National Laboratory Når forskere forsøger at gøre tingene bedre, de vil ofte vende sig til en standardregel og forsøge at modbevise eller forstyrre den. Et konsortium af
Undersøgelse af nye måder at styre termisk stråling påKredit:Lawrence Berkeley National Laboratory Når forskere forsøger at gøre tingene bedre, de vil ofte vende sig til en standardregel og forsøge at modbevise eller forstyrre den. Et konsortium af


