Surhedsaktiverbare dynamiske nanopartikler booster cancerimmunterapi
Kredit:CC0 Public Domain
Immunterapi har et stort potentiale i klinisk cancerbehandling på grund af systematisk aktivering af antitumorimmunitet. Imidlertid, lav immunogenicitet, eller negativ feedback på immunterapi, hæmmer i høj grad effektiviteten af aktuelt anvendt cancerimmunterapi.
I en undersøgelse offentliggjort i Avancerede materialer , et forskerhold ledet af Yu Haijun fra Shanghai Institute of Materia Medica fra det kinesiske videnskabsakademi foreslog surhedsaktiverbare dynamiske nanopartikler for at øge ferroptose og immunogen død (ICD) af tumorceller til cancerimmunterapi.
Ferroptose er en ny type celledød forårsaget af lipidperoxidation (lip-ROS). Reparationsaksen for læbe-ROS indeholder glutamat-cystin-antiporter til syntese af intracellulær glutathion (System XC-) og Glutathione Peroxidase 4 (GPX4), som begge spiller vigtige roller i kampen mod læbe-ROS. De producerede lip-ROS blev rapporteret at fungere som "find-mig"-signaler for at fremme fagocytose af antigen-præsenterende celler og for yderligere at aktivere cytotoksiske T-lymfocytter for at forbedre tumorimmunterapi.
Forskerne syntetiserede først amfifil syrefølsom blokcopolymer kombineret med fotosensibilisator (pyrochlorsyre, PPA) og phenylborsyre gennem hydrofob interaktion og π-π-konjugering for at indkapsle uopløselig GPX4-hæmmer (RSL-3).
Derefter fandt de, at nanopartikler med eksternt lys kan inducere tydelig ICD såvel som cytotoksiske T-lymfocytter, som udskiller IFN-γ. IFN-γ og RSL-3 præsenterede synergistisk hæmning på reparationsaksen og SystemXC—GPX4, mens det øgede akkumuleringen af lipid-ROS i tumorceller, afslører således interaktionen mellem ferroptose og immunterapi.
Derudover forskerne fandt ud af, at nanopartiklerne kombineret med immunkontrolpunktterapi (ICB) dramatisk reducerede tumorinfiltrationen af dedifferentierede tumorceller på en måde af ferroptose.
Undersøgelsen tilbød en ny måde at forbedre ferroptose-medieret tumorimmunterapi.
 Varme artikler
Varme artikler
-
 Nanopartikelsystemet fanger hjertesygdomsbiomarkør fra blod til dybdegående analyseKredit:CC0 Public Domain Forskere ved University of Wisconsin-Madison har udviklet en metode, der kombinerer klæbrige nanopartikler med højpræcisionsproteinmåling for at fange og analysere en fæll
Nanopartikelsystemet fanger hjertesygdomsbiomarkør fra blod til dybdegående analyseKredit:CC0 Public Domain Forskere ved University of Wisconsin-Madison har udviklet en metode, der kombinerer klæbrige nanopartikler med højpræcisionsproteinmåling for at fange og analysere en fæll -
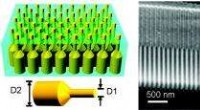 Et nyt twist for nanopillar lyssamlereTil venstre et skema af en germanium nanopillar array indlejret i en aluminiumoxidfoliemembran; til højre er tværsnits-SEM-billeder af en blank aluminiumoxidmembran med porer med dobbelt diameter; ind
Et nyt twist for nanopillar lyssamlereTil venstre et skema af en germanium nanopillar array indlejret i en aluminiumoxidfoliemembran; til højre er tværsnits-SEM-billeder af en blank aluminiumoxidmembran med porer med dobbelt diameter; ind -
 Forskere skaber meget velordnet kunstig spin-is ved hjælp af nanoteknologi(PhysOrg.com) - Et internationalt team af forskere er lykkedes med at skabe kunstig spin-is i en tilstand af termisk ligevægt for første gang, giver dem mulighed for at undersøge den præcise konfigura
Forskere skaber meget velordnet kunstig spin-is ved hjælp af nanoteknologi(PhysOrg.com) - Et internationalt team af forskere er lykkedes med at skabe kunstig spin-is i en tilstand af termisk ligevægt for første gang, giver dem mulighed for at undersøge den præcise konfigura -
 Enkelttrins tilgang til at konstruere elektromagnetiske metamaterialer bruger små selvsamlede søjl…Små selvsamlede kompositter indeholdende metal (såsom guld, gul) søjler indlejret i et oxid tjener som en matrix for metamaterialer, syntetiske materialer med usædvanlige optiske egenskaber (repræsent
Enkelttrins tilgang til at konstruere elektromagnetiske metamaterialer bruger små selvsamlede søjl…Små selvsamlede kompositter indeholdende metal (såsom guld, gul) søjler indlejret i et oxid tjener som en matrix for metamaterialer, syntetiske materialer med usædvanlige optiske egenskaber (repræsent
- Hurtig opladning beskadiger elbils batterier
- Uretan vs Polyurethan
- Supernovaeksplosioner understøttes af neutrinoer fra neutronstjerner, tyder en ny observation på
- Molekylær kirurgi omformer levende væv med elektricitet, men uden indsnit
- Matematik kurser i College
- Du er sandsynligvis mere modtagelig for misinformation, end du tror


