Bioinspirerede elektromekaniske nanogeneratorer til at regulere celleaktivitet
Skematiske illustrationer af elektromekaniske koblingsbio-NG'er, der modulerer celleaktivitet inspireret af ECM. (A) Kollagenfibrene i ECM omdanner cellens iboende kraft til bioelektricitet, som også udgør 3D-arkitekturen i ECM. Disse bioelektriske signaler transmitteres af signalmolekyler fyldt mellem kollagenfibre, dermed, at regulere celleaktivitet og realisere det funktionelle udtryk af celler. (B) Skematisk diagram af de bioinspirerede piezoelektriske fibre i bio-NG'er. Interaktionen af celler med bio-NG'er, der emulerer dette bioelektriske signal i ECM inducerer, som reaktion på de iboende kræfter produceret af cellerne, et lokalt elektrisk felt, der stimulerer og modulerer deres celleaktivitet. Kredit:Science Advances, 10.1126/sciadv.abh2350 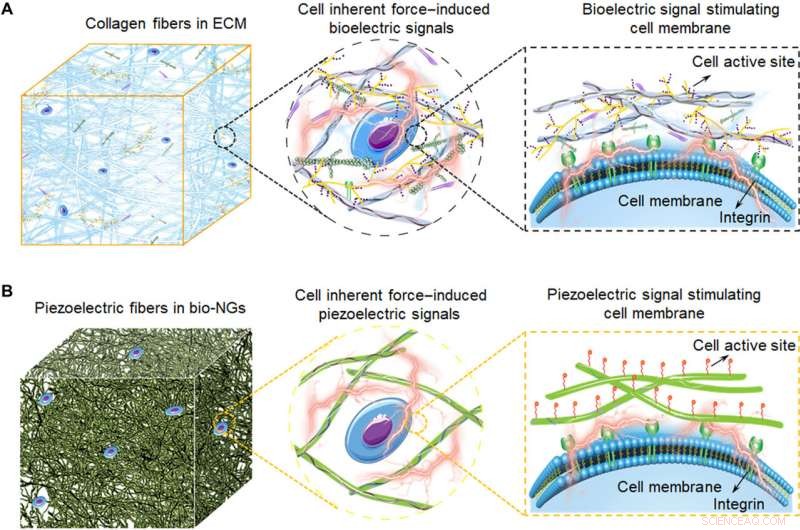
Det unikke 3D-rum i bio-NG'erne gav et ECM-lignende miljø for at fremme cellevækst. Bio-NG'erne fremmede effektivt cellelevedygtighed og udvikling for at opretholde dets specifikke funktionelle udtryk. Forskere forventer, at de nye og avancerede bio-NG'er efterligner kompleksiteten af den ekstracellulære matrix og giver et fysiologisk relevant in vivo biologisk system. Enheden fremmede effektivt cellelevedygtighed og udvikling for at opretholde dets specifikke funktionelle udtryk. Li et al. forventer, at den nye og avancerede version af bio-nanogeneratorer giver et fysiologisk relevant in vivo biologisk system til at erstatte unøjagtige 2D-systemer og dyremodeller.
Vejledning til celler
I dette arbejde, Li et al. skitserede en praktisk strategi for trådløs elektrisk stimulering af celler og væv for at reparere og opretholde cellefunktion. Bioelektricitet er et biofysisk signal, der giver vejledning til cellevækst og -differentiering under embryonal udvikling og vævsregenerering. Endogen bioelektricitet findes i cytoplasmaet og det ekstracellulære rum, at give forskere en ressource til elektrisk stimulering af excitable celler og regulering af cellulær aktivitet til biomedicinske anvendelser. De fleste behandlingsmetoder kræver en ekstern energiinput og ledningsforbindelse for at påføre eksterne elektriske impulser gennem implanterede mikroenheder. Den seneste udvikling inden for nanoteknologi har muliggjort elektrodeløse og batterifrie behandlinger, som omfatter brugen af nanogeneratorer til hjernestimulering, hårregenerering og sårheling. Imidlertid, de fleste af dem kræver en velaccepteret løsning til elektrisk stimulering af de funktionelle celler. Li et al. blev derfor inspireret af den biologiske funktion og mikrostruktur af kollagenfibre i den ekstracellulære matrix til at danne bio-NG'er sammensat af meget diskrete piezoelektriske elektrospundne fibre for at give celler et fysisk relevant mikromiljø. Bio-NG-celle-interaktionen gælder for in vivo-miljøer for at reducere inflammation, inducere hepatocytproliferation, og fremskynde angiogenese, samt fremme leverreparation.
Skematisk repræsentation og piezoelektrisk analyse af bio-NG'er. (A) Skematisk diagram over fremstillingen af meget diskrete piezoelektriske Fe3O4/PAN-fibre. Ved hjælp af neodymjernbormagneten, Fe3O4 magnetiske nanopartikler blev indført i PAN elektrospundet opløsning for at bryde gennem vandets overfladespænding. (B) Det ledende PEDOT lag blev belastet med metoden til in situ polymerisation; GO nanosheets blev adsorberet på det yderste lag af fibre ved bidraget af elektrostatisk adsorptionskraft til at danne mål GO/PEDOT/Fe3O4/PAN fibrene. Transmissionselektronmikroskopibilleder af den enkelte fiber opnået i hvert trin. (C til E) Optisk billede og scanning elektronmikroskopi (SEM) billeder af bio-NG'erne. Indsættelsen af (D) viser porestørrelsesfordeling og porøsitet. Indsatsen af (E) viser fiberdiameterfordelingsområdet for GO/PEDOT/Fe3O4/PAN-fibrene. (F) Finite element-analysesimulering af piezoelektriske fibre koblet med en levende celle, der genererer en maksimal spænding på 141 mV, når de belastes af en tangentiel kraft på 10 nN. (G) Piezoelektrisk potentiale genereret af en enkelt fiber som funktion af den påførte tangentielle cellekraft. (H) Forenklet modstand-kondensator-kredsløb skabt af NG, NG-celle-grænsefladen, og cellemembranen. (I) Piezoelektrisk kraftmikroskopi (PFM) fase- og PFM-amplitudebilleder af en enkelt fiber i bio-NG'er. (J) Faseelektrisk potentialhysterese og sommerfugleamplitudeløkker af fibre i bio-NG'er, opnået med en jævnspænding varierende fra −10 til 10 V. (K) Spændingsoutput fra bio-NG'erne under samme slagkraft på 1 N (blå) og under en vibration ved 0,7 Hz (rød). Indsatsen repræsenterede slag (venstre) og vibration (højre) metoder, der blev brugt til at karakterisere fibrene i bio-NG'er. F, kraft. Billedkredit:Chuanmei Shi, Nanjing University of Science and Technology. Kredit:Science Advances, 10.1126/sciadv.abh2350 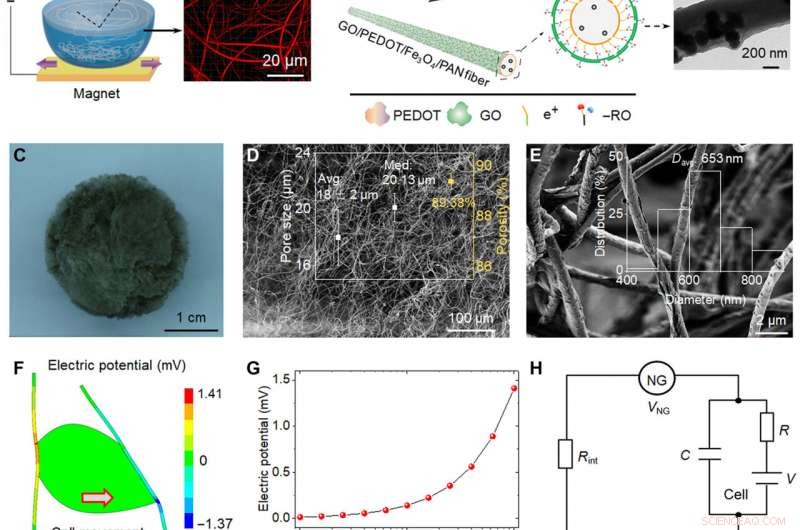
Under forsøgene, forskerholdet introducerede magnetiske nanopartikler af jernoxid i polyacrylonitril for at forberede meget diskrete fibre til brug som en magnetisk-assisteret elektrospinningsenhed. Under elektrospinning, opsætningen muliggjorde dannelsen af stilladser med godt forbundne porer og diskrete fibre til cellefri migration. For at forberede et tættere på-in-vivo mikromiljø, holdet bidrog også med bioelektricitet som et biofysisk signal. For at opnå dette, forskerne udviklede et målstillads til at fremme celleinteraktion og adhæsion med fibre. Den elektromekaniske kobling af bio-NG'er samlet af stilladset fremmede transmissionen og kommunikationen af signaler mellem celler for at efterligne de bioelektriske virkninger af kollagenfibriller eller fibre i den ekstracellulære matrix. Holdet simulerede og studerede det piezoelektriske potentiale genereret fra cellekraft i bio-NG'er ved hjælp af finite element analyse. For at opnå dette, de påførte en belastningskraft på celle-fiber-kontakten og målte først piezoelektriciteten af en enkelt fiber i bio-NG'er ved hjælp af piezoelektrisk kraftmikroskopi. De eksperimentelle spændingssignaler validerede bio-NG'ernes teoretiske piezoelektricitet.
Karakterisering af bio-NG'erne og regulering af celleaktivitet
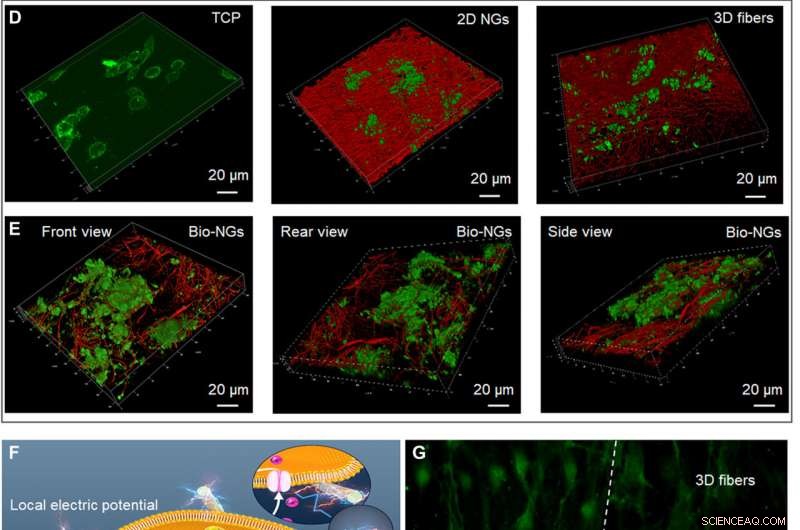
Væksten og udviklingen af RGC5-neuroner i bio-NG'er. (A) Proliferation af RGC5-neuroner ved DNA-assayet på dag 1, 3, og 5. (B) Apoptose af RGC5-neuroner efter 5 dages dyrkning i bio-NG'er. (C) Neuritudvækst af RGC5-neuroner med medianneuritlængden efter 5 dages dyrkning i bio-NG'er. (D) 3D konfokal scanning af RGC5 neuroner dyrket på TCP, 2D NG'er, og 3D-fibre. (E) 3D konfokal scanning af RGC5 neuroner dyrket i bio-NG'er fra forskellige perspektiver. (F) Iboende cellekraft af levende celler dyrket i bio-NG'er. Dette ville inducere et lokalt elektrisk felt proportionalt med belastningsniveauet, som i sidste ende kunne ændre membranpotentialet og/eller konfigurationen af membranreceptorer og resultere i åbningen af Ca2+-kanalerne. Ins3P, inositol trisphosphat. PLC, phospholipase C. (G) Fluorescensbillederne af cellerne præinkuberet med Fluo-4 AM (membranpermeabelt og Ca2+-afhængigt farvestof) på fibrene i bio-NG'er og 3D-fibre. Grøn, Ca2+. Alle fejlbjælker angiver ±SD. Kredit:Science Advances, 10.1126/sciadv.abh2350
For at undersøge informationen om fibrene i bio-NG'er, holdet brugte Fourier Transform Infrared (FTIR) og X-ray diffraction (XRD) spektre. De undersøgte derefter de termodynamiske egenskaber af de piezoelektriske fibre i bio-NG'er ved hjælp af differential scanning calorimetry (DSC) termogrammer og udførte cykliske voltammogramundersøgelser for at teste ladningslagrings- og transmissionsegenskaberne af de piezoelektriske fibre i bio-NG'er. Holdet testede derefter fibrenes trykfasthed og mekaniske egenskaber ved først at danne cylindriske former af dem og komprimere stilladserne for at forstå den fremragende elasticitet af konstruktionerne. Fibrenes mekaniske egenskaber og elasticitet sikrede, at bio-NG'erne effektivt kunne opretholde en stor nok porestørrelse og stabilt 3D-vækstmikromiljø til cellebevægelse og vækst. Holdet undersøgte også NG-celle-interaktionen i 3D-rum med to forskellige cellelinjer inklusive
retinal ganglioncelle 5 (RGC5) og primære hepatocytter. Cellerne indeholdt spændingsstyrede calciumkanaler i deres membraner, og andre var bevægelige celler med høje metaboliske funktioner. Ved hjælp af todimensionelle nanogeneratorer (NG'er) og ikke-piezoelektriske 3D-fibre studerede holdet virkningerne af 3D-rum og elektrisk stimulation på celler. Dataene viste, hvordan bio-NG'erne kunne give et biovenligt cellekulturmikromiljø til yderligere eksperimenter.
Fremme in vivo leverreparation med bio-NG'er
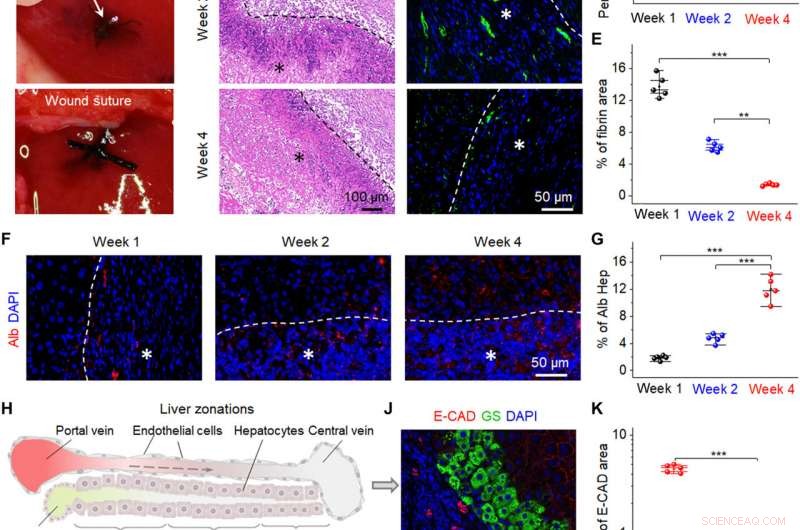
Fremme af leverreparation af bio-NG'er in vivo. (A) Kirurgiske billeder, der viser implantationen af bio-NG'erne i leverdefekten. (B) H&E-farvning af leversektionerne på forskellige tidspunkter (uge 1, 2, og 4) efter implantation. (C) Repræsentative billeder af hepatisk fibrin(ogen) immunfarvning (grøn) i 4′, 6-diamidino-2-phenylindol (DAPI) (blå)-modfarvede leversektioner ved det implanterede område. (D) Gennemsnitlig procentdel af det positive område målt fra H&E-farvning. (E) Kvantificering af hepatisk fibrin-immunfluorescerende mærkning. (F) Immunfarvning for Alb (rød) på leversektioner på forskellige tidspunkter (uge 1, 2, og 4) efter implantation. (G) Alb-ekspressionsniveau målt fra Alb-immunfarvning. (H) Skematisk, der viser tre leverzoner fra periportalen til den pericentrale region. 1, 2, og 3 angiver zone 1 (E-CAD+), zone 2 (E-CAD─GS─), og zone 3 (GS+), henholdsvis. Den stiplede pil angiver blodgennemstrømning. (I og J) Immunfarvning for GS (grøn) og E-CAD (rød) på leversektioner i den fjerde uge efter implantation. (K) Kvantificering af GS og E-CAD, der viser stærkere ekspression af leverfunktion af nye hepatocytter i bio-NG'er end for 3D-fibre. Hep, hepatocyt. Stjerner (*) viser placeringen af implantationen. Data er udtrykt som middelværdier ± SD. n =5. **P <0,01 og ***P <0,001. Billedkredit:Fei Jin, Nanjing University of Science and Technology. Kredit:Science Advances, 10.1126/sciadv.abh2350
Forskerne implanterede derefter bio-NG'erne i et område med leverskade i forhold til hepatocytregenerering for at afspejle deres praktiske funktion. For at opnå dette, de brugte Sprague-Dawley rotter til at fremkalde leverskade. Efter fire ugers implantation af bio-NG'erne, holdet fjernede implantaterne og undersøgte inflammation ved hjælp af histologisk farvning. De bemærkede mild betændelse i den første uge, som blev forbedret i den anden uge og reduceret til normale niveauer i den fjerde uge. Alle andre organer viste ikke deformation eller unormal lymfatisk celleinvasion for at indikere gode helbredsforhold uden systematiske bivirkninger. Den observerede regenerative proces fremhævede et nyt blodcirkulationssystem, der blev dannet inde i regenereret levervæv for at foreslå interaktionen af bio-NG'er med celler for at reducere inflammation og fremme vævsreparation.
Langsigtet stabilitet og biokompatibilitet af bio-NG'er in vivo
NG-celle-interaktionen fremmede effektivt cellelevedygtighed og opretholdt dens funktionelle ekspression in vitro og in vivo for at give en behandlingsstrategi for kliniske forsøg. Til vævsregenerering, det er mest effektivt at transplantere funktionelle celler direkte ind i det beskadigede sted in vivo. For yderligere undersøgelser, holdet implanterede bio-NG'erne i gastrocnemius muskelområdet omkring iskiasnerven hos rotter for at detektere stabiliteten af bio-NG'erne in vivo. Li et al. fjernede derefter implantaterne efter otte uger og analyserede inflammation for at vise god biokompatibilitet af bio-NG'er i længere perioder i biologiske miljøer uden systemiske bivirkninger. Konstruktionerne er lovende som implantater til in vivo regenerativ reparation.
In vivo stabilitet og biokompatibilitet af bio-NG'er. Kirurgisk billede, der viser implantationen af bio-NG'erne i (A) gastrocnemius-musklen og (B) iskiasnerveområder på en mus. (C) Masson trichrome farvning af gastrocnemius muskler ved det implanterede område. (D) TNF-α immunfluorescerende farvning af iskiasnerven ved det implanterede område. (E) Gennemsnitlig procentdel af kollagenfibre i muskelvævet målt fra Masson-farvning. (F) Relativt TNF-a-ekspressionsniveau målt fra TNF-a-immunfluorescerende farvning. (G) H&E-farvning af vitale organer (lever, hjerte, lunge, nyre, og hjerne) i uge 8 efter implantation i iskiasnerven. Data er udtrykt som middelværdier ± SD. n =5. ***P <0,001. Billedkredit:Tong Li, Nanjing University of Science and Technology. Kredit:Science Advances, 10.1126/sciadv.abh2350 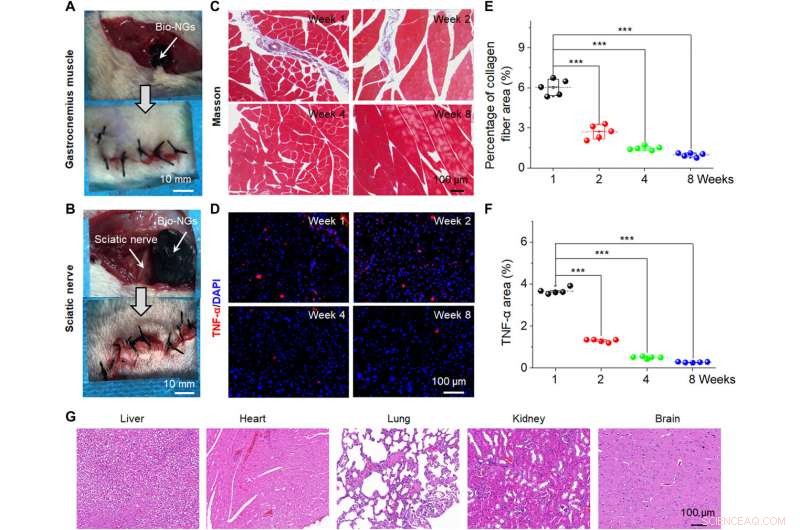
På denne måde Tong Li and colleagues developed extracellular matrix-like electromechanical coupling bio-nanogenerators (bio-NGs) to regulate cell activity and maintain its specific functional expression. The product created a local voltage potential to stimulate living cells as long as they remained motile. The unique environment facilitated cell culture in bio-NGs to trigger the opening of ion channels present in the cellular plasma membrane to achieve electrical stimulation at the single-cell level. The process offers great potential for bioelectronic medicine and cell-targeted local electrical impulses. The new method can replace inaccurate 2D systems and time-consuming animal models to provide a biomimetic, physiological microenvironment for accelerated tissue regeneration and bioinspired electronic medicine.
© 2021 Science X Network
 Varme artikler
Varme artikler
-
 På 2D-skalaen, isotopsammensætning har uforudsete effekter på lysemissionKredit:Los Alamos National Laboratory Sammenlignet med bulkmaterialer, atomisk tynde materialer som overgangsmetal dichalcogenider (TMDer) tilbyder størrelse og tunability fordele i forhold til tr
På 2D-skalaen, isotopsammensætning har uforudsete effekter på lysemissionKredit:Los Alamos National Laboratory Sammenlignet med bulkmaterialer, atomisk tynde materialer som overgangsmetal dichalcogenider (TMDer) tilbyder størrelse og tunability fordele i forhold til tr -
 Forskere opnår gennembrud inden for nanokomposit til brintlagring med høj kapacitetTransmissionselektronmikrofotografier af et luftstabilt kompositmateriale bestående af metalliske magnesium nanokrystaller i en gasbarriere polymermatrix, der muliggør lagring med høj densitet og hurt
Forskere opnår gennembrud inden for nanokomposit til brintlagring med høj kapacitetTransmissionselektronmikrofotografier af et luftstabilt kompositmateriale bestående af metalliske magnesium nanokrystaller i en gasbarriere polymermatrix, der muliggør lagring med høj densitet og hurt -
 En lille skala løsning med stor effektEn computerchip, der bruger molybdændisulfid-inverteren. Foto:Brooks Canaday (Phys.org)—Mikrochips er gennemgående i nutidens højteknologiske samfund, spiller en integreret rolle i din mobiltelefo
En lille skala løsning med stor effektEn computerchip, der bruger molybdændisulfid-inverteren. Foto:Brooks Canaday (Phys.org)—Mikrochips er gennemgående i nutidens højteknologiske samfund, spiller en integreret rolle i din mobiltelefo -
 Skriver med elektronstrålen - nu i sølvScannende elektronmikrografer viser en 10-mikron plan aflejring. De konstituerende sølvkrystaller er ca. 100 nanometer store. Kredit:HZB/ ACS anvendte materialer og grænseflader (2017) Når det k
Skriver med elektronstrålen - nu i sølvScannende elektronmikrografer viser en 10-mikron plan aflejring. De konstituerende sølvkrystaller er ca. 100 nanometer store. Kredit:HZB/ ACS anvendte materialer og grænseflader (2017) Når det k
- Det nye spil russisk roulette til brandudsatte økosystemer
- Miljøvenlig, industrielle skum fra vedvarende ressourcer
- Magnetiske nanopartiklers rolle i behandling af brystkræft
- Bedste praksis for at forhindre den føderale regering i at sprænge sit teknologibudget
- Atomisk kyllingetråd er nøglen til hurtigere DNA-sekventering
- Bambus inspirerer til optimalt design for lethed og sejhed


