Næste generations patientavatarer:Udvidelse af mulighederne med mikroorganosfærer

Billede, der afbilder mikroorganosfærer (MOS), der indkapsler primære vævsafledte celler før demulgering. Kredit:Terasaki Institute for Biomedical Innovation
Et team af forskere, ledet af Xiling Shen, Ph.D., Chief Scientific Officer og professor ved Terasaki Institute for Biomedical Innovation (TIBI), har nået nye niveauer i udvikling af patientmodeller. De har udviklet forbedrede metoder til generering af mikroorganosfærer (MOS) og har vist, at disse MOS har overlegne evner til en række forskellige kliniske anvendelser. Som dokumenteret i en nylig publikation i Stam Cell Reports , kan deres MOS bruges som patientavatarer til undersøgelser, der involverer direkte viral infektion, immuncellepenetration og high-throughput terapeutisk lægemiddelscreening, noget der ikke kan opnås med konventionelle patientafledte modeller.
Dr. Shens team har udviklet emulsionsmikrofluidisk teknologi til at skabe MOS, som er bittesmå, nanoliter-størrelse basalmembranekstrakt (BME) dråber sammensat af vævscelleblandinger, der kan genereres i et hurtigt tempo fra en automatiseret enhed. Når dråberne er dannet, fjernes overskydende olie ved en innovativ membrandemulgeringsproces, der efterlader tusindvis af tyktflydende, ensartede dråber, som indeholder bittesmå 3D-vævsstrukturer.
Holdet fortsatte med at demonstrere unikke MOS-egenskaber og funktioner i flere første af deres slags eksperimenter. De var i stand til at vise, at MOS kunne skabes fra en række forskellige vævskilder, og den resulterende MOS havde tilbageholdelse af histopatologisk morfologi, evne til differentiering og genetisk ekspression og evnen til at blive frosset og sub-dyrket, som i konventionelle organoider .
Eksperimenter blev udført for at teste evnen til at inficere MOS med vira. I modsætning til konventionelle organoider kan MOS inficeres direkte med vira uden fjernelse og suspension af celler fra dets omgivende BME-stillads, og dermed rekapitulere processen med viral infektion af værtsvævet. Dr. Shens team var i stand til at skabe et MOS-atlas af menneskeligt åndedræts- og fordøjelsesvæv fra patientobduktioner og inficere dem med SARS-COV-2-vira, efterfulgt af lægemiddelscreening for at identificere lægemidler, der blokerer viral infektion og replikation i disse væv.
MOS giver også en unik platform til at studere og udvikle immuncelleterapi. Inden for naturlig diffusionsgrænse for vaskulariseret væv tillod tumor-afledt MOS tilstrækkelig penetration af terapeutiske immun-T-celler såsom CAR-T, hvilket muliggjorde en ny T-celle-styrkeassay til at vurdere tumordrab af de konstruerede T-celler. En sådan model ville være yderst nyttig til at undersøge tumorrespons og til udvikling af antitumorimmuncelleterapier.
MOS kunne yderligere integreres med deep-learning billeddannelsesanalyse til hurtig lægemiddeltestning af små og heterogene kliniske tumorbiopsier. Desuden var algoritmen i stand til at skelne mellem cytotoksiske vs. cytostatiske lægemiddeleffekter og lægemiddelresistente kloner, der vil give anledning til senere tilbagefald. Denne banebrydende evne vil bane vejen for, at MOS kan bruges i klinikken til at informere terapeutiske beslutninger.
"Dr. Shen og hans team fortsætter med at forfine og forbedre MOS-teknologien og sætte fokus på dens alsidighed, ikke kun som en fysiologisk model til screening af potentielle personlige behandlinger, men også til sygdomsstudier og en række andre anvendelser," sagde Ali Khademhosseini, Ph.D., TIBIs direktør og administrerende direktør. "Det ser ud til at blive fremtidens bølge for præcisionsmedicin." + Udforsk yderligere
Patient-afledte mikro-organosfærer muliggør banebrydende præcision onkologi
 Varme artikler
Varme artikler
-
 Kemikere udvikler ny teknik til nanostruktursamlingEn kunstnerisk gengivelse af en superpartikel dannet af selvsamlende nanoroder. Kredit:Dustin S. LaMontagne Et team af forskere fra University of Florida afdeling for kemi har udviklet en ny tekni
Kemikere udvikler ny teknik til nanostruktursamlingEn kunstnerisk gengivelse af en superpartikel dannet af selvsamlende nanoroder. Kredit:Dustin S. LaMontagne Et team af forskere fra University of Florida afdeling for kemi har udviklet en ny tekni -
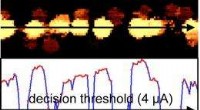 Ny sondehukommelse kan opnå brugerdensiteter over 10 terabit per kvadrattommeDette billede viser registrerede bits med marklængde med den tilsvarende strøm nedenfor. Billedkredit:Wright, et al. © 2010 American Institute of Physics. (PhysOrg.com)-Forskere har foreslået en n
Ny sondehukommelse kan opnå brugerdensiteter over 10 terabit per kvadrattommeDette billede viser registrerede bits med marklængde med den tilsvarende strøm nedenfor. Billedkredit:Wright, et al. © 2010 American Institute of Physics. (PhysOrg.com)-Forskere har foreslået en n -
 Magnetiske fjedre nedbryder havmikroplastforureningMikroplastrester i kosmetik under optisk mikroskopi. Kredit:Xiaoguang Duan / Matter Plastaffald, der finder vej til oceaner og floder, udgør en global miljøtrussel med skadelige sundhedsmæssige ko
Magnetiske fjedre nedbryder havmikroplastforureningMikroplastrester i kosmetik under optisk mikroskopi. Kredit:Xiaoguang Duan / Matter Plastaffald, der finder vej til oceaner og floder, udgør en global miljøtrussel med skadelige sundhedsmæssige ko -
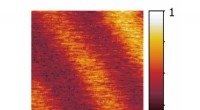 Optisk metode til alle formål til at observere fysiske, kemiske eller biologiske processer på nano…Undersøgelse af en kendt tyndtlagsprøve ved hjælp af det nye nanoskop. Laserimpulser exciterer elektronerne i de lyse striber, hvorved den ellers gennemsigtige prøve på disse steder bliver refleksiv.
Optisk metode til alle formål til at observere fysiske, kemiske eller biologiske processer på nano…Undersøgelse af en kendt tyndtlagsprøve ved hjælp af det nye nanoskop. Laserimpulser exciterer elektronerne i de lyse striber, hvorved den ellers gennemsigtige prøve på disse steder bliver refleksiv.
- Sig ost på Mars:Perseverances selfie med opfindsomhed
- Robotikere opdager alternativ fysik
- Spænding på Island som hvilende vulkansk zone viser tegn på liv
- Nanoshells hjælper med at dræbe brysttumorer
- Forskere afslører skyrmion-fysik drevet af magnoner i begrænsede geometrier
- Enkeltatom-tynd platin er en fantastisk kemisk sensor


